Ilt (oxygen, O) – kemisk grundstof: egenskaber, rolle og anvendelser
Ilt (O) — egenskaber, rolle og anvendelser: Lær om oxygen i atmosfæren, fotosyntese, sundhed, industri, svejsning og raketbrændstof.
Ilt er et kemisk grundstof. Det har symbolet O og atomnummer 8. Det er det tredje mest almindelige grundstof i universet efter hydrogen og helium.
Ilten udgør mere end en femtedel af Jordens atmosfære i volumen. I luften er der normalt to iltatomer, som går sammen og danner dioxygen (O
2), en farveløs gas. Denne gas kaldes ofte bare ilt. Den har ingen smag eller lugt. Den er lyseblå, når den er flydende eller fast.
Oxygen er en del af chalcogen-gruppen i det periodiske system. Det er et meget reaktivt ikke-metal. Det danner oxider og andre forbindelser med mange grundstoffer. Oxygen i disse oxider og i andre forbindelser (hovedsagelig silikatmineraler og calciumcarbonat i kalksten) udgør næsten halvdelen af Jordens skorpe, målt i masse.
De fleste levende væsener bruger ilt til at trække vejret. Mange molekyler i levende væsener indeholder ilt, f.eks. proteiner, nukleinsyrer, kulhydrater og fedtstoffer. Ilt er en del af vand, som alt kendt liv har brug for for at leve. Alger, cyanobakterier og planter fremstiller jordens iltgas ved hjælp af fotosyntese. De bruger solens lys til at få brint fra vand og afgiver ilt.
I toppen af Jordens atmosfære findes ozon (O
3), i ozonlaget. Det absorberer ultraviolet stråling, hvilket betyder, at mindre stråling når ned til jordoverfladen.
Iltgas anvendes til fremstilling af stål, plast og tekstiler. Den har også medicinske anvendelser og bruges til at trække vejret, når der ikke er god luft (f.eks. af dykkere og brandmænd), og til svejsning. Flydende ilt og iltrige forbindelser kan anvendes som raketdrivmiddel.
Egenskaber og fysisk-kemiske data
Ilt har atomnummer 8 og en gennemsnitlig atommasse på cirka 15,999 u. Den elektroniske konfiguration er 1s2 2s2 2p4, hvilket giver fire valenselektroner og forklarer dets høje reaktivitet. På standardbetingelser er dioxygen (O2) en farveløs, lugtfri gas med et volumenindhold i tør luft på cirka 20,95 %.
Vigtige fysiske data (omtrentlig):
- Smeltepunkt (O2): −218,79 °C
- Kogepunkt (O2): −182,96 °C
- Væske og fast ilt er lyseblå.
- O2 er paramagnetisk (har to upræparrede elektroner) og tiltrækkes af magnetfelter.
- Elektronegativitet (Pauling): omkring 3,44.
Allotroper og isotoper
Den mest almindelige allotrop er dioxygen (O2), som er nødvendig for almindelig aerob respiration. En anden vigtig allotrop er ozon (O3), som i stratosfæren beskytter mod UV-stråling, men ved jordoverfladen er det en skadelig luftforurenende gas.
De stabile isotoper er 16O (≈99,76 %), 17O og 18O. Radioaktive isotoper som 15O anvendes i medicinsk billeddannelse (PET-scanning), men har kort halveringstid.
Biologisk rolle og kredsløb
Ilt er centralt i organismers stofskifte: under aerob respiration fungerer O2 som den terminale elektronacceptor i elektrontransportkæden, hvilket frigiver energi (ATP) fra føde. Uden tilstrækkelig ilt kan organismer skifte til mindre effektive anaerobe processer.
Fotosyntese hos alger, cyanobakterier og planter omdanner CO2 og vand til organiske stoffer og frigiver O2. Denne proces førte til iltning af Jordens atmosfære (den såkaldte Great Oxidation Event) for milliarder af år siden, og den opretholder i dag atmosfærens iltindhold.
I havene opløses ilt i overfladevandet; opløseligheden falder med stigende temperatur og salinitet. Lavt opløst ilt i kystområder kan føre til “døde zoner” (hypoxi), der skader marint liv.
Fremstilling
Industrielt fremstilles ilt primært ved fraktioneret destillation af flydende luft, hvor luften køles ned og de enkelte bestanddele adskilles. Mindre anlæg og medicinsk ilt laves ofte ved tryk-svingende adsorption (PSA), som separerer O2 fra luft ved hjælp af molekylsigte. Der findes også elektrolyse af vand (især til industrielle brint/ilt-processer) og kemiske generatorer (f.eks. til nødsituationer).
Anvendelser
- Industri: stål-produktion (basic oxygen process), fremstilling af kemikalier, oxidationsprocesser.
- Svejsning og skæring: oxy-fuel teknikker og ilttilførsel til plasmaskæring.
- Raketmotorer: flydende ilt som oxidationsmiddel i kombination med brændstof (f.eks. flydende hydrogen).
- Medicinsk: iltterapi, respiratorunderstøttelse, hyperbar oxygenbehandling.
- Dykning og brandvæsen: iltgiverapparater til at sikre åndedræt i iltfattige eller forurenede omgivelser (dykkere, brandmænd).
- Miljø: iltning af spildevand, akvakultur og andre processer, hvor opløst ilt er kritisk.
Sikkerhed og miljømæssige aspekter
Ilt er ikke brændbar, men er et stærkt oxidationsmiddel og øger hastigheden og intensiteten af forbrænding. Materialer, der normalt brænder langsomt i luft, kan antændes voldsomt i iltrige omgivelser. Håndtering af flydende ilt kræver forsigtighed på grund af ekstrem kulde og risiko for sprødhed i materialer.
Ved høje ilttryk kan mennesker få iltforgiftning (pulmonal eller CNS-iltforgiftning), især ved dykning med højt omgivende tryk. Også langvarig eksponering for forhøjede iltkoncentrationer bruges kun under kontrol.
Miljømæssigt er tab af opløst ilt i havet og vandløb et voksende problem pga. opvarmning og eutrofiering. Ozon ved jordoverfladen er skadelig for sundhed og vegetation, mens ozon i stratosfæren er beskyttende.
Historie
Oxygen blev opdaget i 1770'erne af flere forskere uafhængigt: Carl Wilhelm Scheele (først, men publicerede senere) og Joseph Priestley (1774) lavede tidlige eksperimenter. Antoine Lavoisier forklarede gasens rolle i forbrænding og navngav stoffet "oxygène" (ilt, bogstaveligt "syre-danner", ud fra en fejlagtig teori om syrers natur), og han banede vejen for moderne kemi.
Praktiske bemærkninger
Når man taler om iltkoncentration i praktiske sammenhænge, er det nyttigt at kende partialtryk (pO2), især inden for medicin og dykning, hvor pO2 bestemmer risiko for hypoxi eller iltforgiftning. Også sensorer (iltmålere) bruges bredt til at overvåge atmosfærisk O2 og opløst ilt i vand.
Samlet set er ilt et af de mest vigtige grundstoffer for kemi, industri og liv på Jorden: fra at understøtte forbrænding og respiration til at forme planetens geokemi og beskytte mod skadelig stråling gennem ozonlaget.
Historie
Iltgas (O
2) blev isoleret af Michael Sendivogius før 1604. Det menes ofte, at gassen blev opdaget i 1773 af Carl Wilhelm Scheele i Sverige eller i 1774 af Joseph Priestley i England. Priestley anses normalt for at være hovedopdageren, fordi hans arbejde blev offentliggjort først (selv om han kaldte det "dephlogisticated air" og ikke mente, at det var et kemisk grundstof). Antoine Lavoisier gav gassen navnet oxygène i 1777. Han var den første person, der sagde, at det var et kemisk grundstof. Han havde også ret i, at det hjælper forbrændingen til at fungere.
Tidlige eksperimenter
Et af de første kendte eksperimenter om, hvordan forbrænding kræver luft, blev udført af grækeren Philo af Byzans i det 2. århundrede f.Kr. Han skrev i sit værk Pneumatica, at hvis man vendte en beholder på hovedet over et brændende stearinlys og fyldte vand omkring beholderen, blev noget vand ført ind i beholderen. Philo mente, at dette skyldtes, at luften blev omdannet til det klassiske element ild. Dette er forkert. Lang tid efter fandt Leonardo da Vinci ud af, at der blev brugt noget luft under forbrændingen, og at dette tvang vand ind i karret.
I slutningen af det 17. århundrede fandt Robert Boyle ud af, at luft er nødvendig for forbrænding. Den engelske kemiker John Mayow supplerede dette ved at vise, at ild kun havde brug for en del luft. Vi kalder nu denne del for ilt (O2 ). Han fandt ud af, at et stearinlys, der brændte i en lukket beholder, fik vandet til at stige og erstatte en fjortende del af luftens volumen, før det slukkede. Det samme skete, når en levende mus blev lagt i kassen. Ud fra dette fandt han ud af, at ilt bruges til både respiration og forbrænding.
Phlogiston-teorien
Robert Hooke, Ole Borch, Mikhail Lomonosov og Pierre Bayen lavede alle ilt i eksperimenter i det 17. og 18. århundrede. Ingen af dem troede, at det var et kemisk grundstof. Det skyldtes sandsynligvis ideen om phlogiston-teorien. Det var det, som de fleste mennesker troede var årsag til forbrænding og korrosion.
J. J. Becher kom med teorien i 1667, og Georg Ernst Stahl supplerede den i 1731. Phlogiston-teorien fastslog, at alle brændbare materialer bestod af to dele. Den ene del, kaldet phlogiston, blev afgivet, når det stof, der indeholdt det, blev brændt.
Materialer, der efterlader meget få rester, når de brænder, som f.eks. træ eller kul, blev anset for at være lavet hovedsagelig af phlogiston. Ting, der korroderer, som f.eks. jern, blev anset for at indeholde meget lidt. Luft var ikke en del af denne teori.
Opdagelse
Den polske alkymist, filosof og læge Michael Sendivogius skrev om noget i luften, som han kaldte "livets føde", og det betød det, vi i dag kalder ilt. Sendivogius fandt mellem 1598 og 1604 ud af, at stoffet i luften er det samme som det, han fik ved at opvarme kaliumnitrat. Nogle mener, at dette var opdagelsen af ilt, mens andre er uenige. Nogle siger, at ilten blev opdaget af den svenske farmaceut Carl Wilhelm Scheele. Han fik ilt i 1771 ved at opvarme kviksølvoxid og nogle nitrater. Scheele kaldte gassen for "ildluft", fordi det var den eneste gas, der vides at kunne give forbrænding (gasser blev kaldt "luft" på dette tidspunkt). Han offentliggjorde sin opdagelse i 1777.
Den 1. august 1774 fokuserede den britiske præst Joseph Priestley sollys på kviksølvoxid i et glasrør. Ved dette forsøg fik han en gas, som han kaldte "dephlogisticated air". Han fandt ud af, at stearinlys brændte kraftigere i gassen, og at en mus levede længere, mens den indåndede den. Efter at have indåndet gassen sagde Priestley, at det føltes som normal luft, men at hans lunger føltes lettere og lette bagefter. Hans resultater blev offentliggjort i 1775. Det er fordi hans resultater blev offentliggjort først, at han ofte siges at have opdaget ilten.
Den franske kemiker Antoine Lavoisier sagde senere, at han også havde opdaget stoffet. Priestley besøgte ham i 1774 og fortalte ham om sit eksperiment. Scheele sendte også et brev til Lavoisier samme år, hvori han omtalte sin opdagelse.
Lavoisiers forskning
Lavoisier udførte de første vigtige eksperimenter om oxidation. Han var den første, der forklarede, hvordan forbrænding fungerer. Han brugte disse og andre eksperimenter til at bevise, at phlogiston-teorien var forkert. Han forsøgte også at bevise, at det stof, som Priestley og Scheele havde opdaget, var et kemisk grundstof.
I et forsøg fandt Lavoisier ud af, at der ikke skete nogen vægtforøgelse, når tin og luft blev opvarmet i en lukket beholder. Han fandt også ud af, at luften strømmede ind, når beholderen blev åbnet. Derefter fandt han ud af, at tinets vægt var steget med samme mængde som vægten af den luft, der var strømmet ind. Han offentliggjorde sine resultater i 1777. Han skrev, at luft bestod af to gasser. Den ene kaldte han "vital luft" (ilt), som er nødvendig for forbrænding og respiration. Den anden (nitrogen) kaldte han "azote", som betyder "livløs" på græsk. (Dette er stadig navnet på nitrogen på nogle sprog, bl.a. fransk).
Lavoisier omdøbte "vital luft" til "oxygène", der kommer fra græsk og betyder "syrefremstilling" eller "syreproducent". Han kaldte det sådan, fordi han troede, at der var ilt i alle syrer, hvilket er forkert. Senere kemikere indså, at Lavoisers navn for gassen var forkert, men navnet var på det tidspunkt for almindeligt til at blive ændret.
"Oxygen" blev navnet på engelsk, selv om engelske forskere var imod det.
Senere historie
John Daltons atomteori sagde, at alle grundstoffer havde ét atom, og at atomerne i forbindelser normalt var alene. Han troede f.eks. fejlagtigt, at vand (H2 O) kun havde formlen HO. I 1805 viste Joseph Louis Gay-Lussac og Alexander von Humboldt, at vand består af to hydrogenatomer og et oxygenatom. I 1811 fandt Amedeo Avogadro korrekt ud af, hvad vand består af på grundlag af Avogadros lov.
I slutningen af det 19. århundrede fandt forskerne ud af, at luft kunne gøres flydende, og at man kunne isolere de forbindelser, den indeholdt, ved at komprimere og afkøle den. Den schweiziske kemiker og fysiker Raoul Pictet opdagede flydende ilt ved at fordampe svovldioxid for at gøre kuldioxid til væske. Dette blev derefter også fordampet for at afkøle iltgas for at gøre det flydende. Han sendte et telegram til det franske videnskabsakademi den 22. december 1877 og fortalte dem om sin opdagelse.

Lavoisier nedbrydning luft
Egenskaber
Egenskaber og molekylær struktur
Ved standardtemperatur og -tryk har ilt ingen farve, lugt eller smag. Det er en gas med den kemiske formel O
2 kaldet dioxygen.
Som dioxygen (eller bare oxygengas) er to oxygenatomer kemisk bundet til hinanden. Denne binding kan kaldes mange ting, men kaldes ganske enkelt en kovalent dobbeltbinding. Oxygengas er meget reaktiv og kan reagere med mange andre grundstoffer. Oxider dannes, når metalelementer reagerer med ilt, f.eks. jernoxid, som er kendt som rust. Der findes mange oxidforbindelser på Jorden.
Allotrope stoffer
Den almindelige allotrope (type) af ilt på Jorden kaldes dioxygen (O2 ). Det er den næststørste del af Jordens atmosfære efter dinitrogen (N2 ). O2 har en bindingslængde på 121 pm og en bindingsenergi på 498 kJ/mol På grund af sin energi anvendes O2 af komplekse organismer som f.eks. dyr.
Ozon (O3 ) er meget reaktivt og skader lungerne, når det indåndes. Ozon dannes i den øvre atmosfære, når O2 kombineres med ren ilt, der dannes, når O2 spaltes af ultraviolet stråling. Ozon absorberer meget stråling i UV-delen af det elektromagnetiske spektrum, og derfor beskytter ozonlaget i den øvre atmosfære Jorden mod stråling.
Over ozonlaget (i lave kredsløb om Jorden) er atomar oxygen den mest almindelige form.
Tetraoxygen (O4 ) blev opdaget i 2001. Det findes kun under ekstreme forhold, når der lægges et stort tryk på O2 .
Fysiske egenskaber
Ilt opløses lettere fra luft i vand end nitrogen. Når der er den samme mængde luft og vand, er der ét molekyle O2 for hver 2 molekyler N (2forholdet 1:2). Dette er anderledes end i luft, hvor der er et forhold mellem ilt og kvælstof på 1:4. Det er også lettere for O2 at opløse sig i ferskvand end i havvand. Oxygen kondenserer ved 90,20 K (-182,95 °C) og fryser ved 54,36 K (-218,79 °C). Både flydende og fast O2 er gennemsigtig og har en lyseblå farve.
Ilt er meget reaktivt og skal holdes væk fra alt, der kan brænde.
Isotoper
Der findes tre stabile isotoper af ilt i naturen. De er16 O,17 O og18 O. Ca. 99,7 % af ilten er isotopen16 O.
Forekomst
Oxygen er det tredje mest almindelige grundstof i universet efter hydrogen og helium. Omkring 0,9 % af Solens masse består af ilt.
| De ti mest almindelige grundstoffer i Mælkevejsgalaksen estimeret spektroskopisk | ||||
| Z | Element | Massefraktion i dele pr. million | ||
| 1 | 739,000 | 71 × iltmasse (rød søjle) | ||
| 2 | 240,000 | 23 × iltmasse (rød streg) | ||
| 8 | Oxygen | 10,400 |
| |
| 6 | 4,600 |
| ||
| 10 | Neon | 1,340 |
| |
Bortset fra jern er ilt det mest almindelige grundstof på Jorden (efter masse). Det udgør næsten halvdelen (46-49,2 %) af Jordens skorpe som en del af oxidforbindelser som f.eks. siliciumdioxid og andre forbindelser som f.eks. carbonater. Det er også den vigtigste bestanddel af Jordens oceaner, idet det udgør 88,8 % af massen. Iltgas er den næstmest almindelige del af atmosfæren og udgør 20,95 % af dens volumen og 23,1 % af dens volumen. Jorden er mærkelig sammenlignet med andre planeter, da en stor del af dens atmosfære består af iltgas. Mars har kun 0,1 % O
2 volumenprocent, mens de andre planeter har mindre end det.
Den meget større mængde iltgas omkring Jorden skyldes iltcyklussen. Fotosyntesen tager brint fra vand ved hjælp af energi fra sollyset. Dette giver iltgas. Noget af brintet kombineres med kuldioxid for at danne kulhydrater. Respirationen tager derefter iltgas fra atmosfæren eller vandet og omdanner det til kuldioxid og vand.
Bruger
Medicinsk
O2 er en meget vigtig del af respirationen. Derfor bruges det i medicin. Det bruges til at øge mængden af ilt i en persons blod, så der kan foregå mere respiration. Det kan få dem til at blive raske hurtigere, hvis de er syge. Oxygenbehandling bruges til at behandle emfysem, lungebetændelse, visse hjerteproblemer og enhver sygdom, der gør det sværere for en person at optage ilt.
Livsstøtte
Lavtryks O2 anvendes i rumdragter, hvor kroppen omgives af gassen. Der anvendes ren ilt, men ved et meget lavere tryk. Hvis trykket var højere, ville det være giftigt.
Industriel
Smeltning af jernmalm til stål bruger ca. 55 % af den ilt, som mennesker producerer. Til dette formål sprøjtes O2 gas ind i malmen gennem en lanse under højt tryk. Herved fjernes svovl eller kulstof fra malmen, som ikke er ønsket. De frigives som svovloxid og kuldioxid. Temperaturen kan nå op på 1 700 °C, fordi det er en exotermisk reaktion.
Ca. 25 % af den ilt, som mennesker producerer, bruges af kemikere. Ethylen reageres med O2 for at fremstille ethylenoxid. Dette omdannes derefter til ethylenglycol, som bruges til at fremstille mange produkter som f.eks. frostvæske og polyester (som derefter kan omdannes til plastik og stof).
De øvrige 20 % af den ilt, som mennesket producerer, bruges til medicin, skæring og svejsning af metal, raketbrændstof og vandbehandling.

En iltkoncentrator i en emphysempatients hus
Forbindelser
Oxygenets oxidationstrin er -2 i næsten alle forbindelser, som det indgår i. I nogle få forbindelser er oxidationstallet -1, f.eks. i peroxider. Forbindelser af ilt med andre ilttilstande er meget ualmindelige.
Oxider og andre uorganiske forbindelser
Vand (H
2O) er et oxid af hydrogen. Det er det mest almindelige oxid på jorden. Alt kendt liv har brug for vand for at leve. Vand består af to hydrogenatomer, der er kovalent bundet til et oxygenatom (oxygen har en højere elektronegativitet end hydrogen). (dette er det grundlæggende princip for kovalent binding) Der er også elektrostatiske kræfter (Van de'r Waals-kræfter) mellem hydrogenatomerne og de tilstødende molekylers oxygenatomer. Disse pseudobindinger bringer atomerne ca. 15 % tættere på hinanden end de fleste andre simple væsker. Dette skyldes, at vand er et polært molekyle (netto asymmetrisk fordeling af elektroner) på grund af sin bøjede form, hvilket giver det en samlet nettofeltretning, hovedsagelig på grund af oxygenatomerens 2 ikke-bindende elektronpar, der skubber de bindende H'er længere sammen end den lineære opstilling med lavere enthalpi (se CO2 ). Denne egenskab udnyttes af mikrobølger til at svinge polære molekyler, især vand. Og den er ansvarlig for den ekstra energi, der er nødvendig for at adskille H 0. 2
På grund af iltets høje elektronegativitet indgår det kemiske bindinger med næsten alle andre kemiske grundstoffer. Disse bindinger giver oxider (f.eks. reagerer jern med ilt og giver jernoxid). De fleste metallers overflader omdannes til oxider, når de befinder sig i luft. Jerns overflade bliver til rust (jernoxid), når den er i luften i lang tid. Der er små mængder af kuldioxid (CO
2) i luften, og det omdannes til kulhydrater under fotosyntesen. Levende væsener afgiver det under respirationen.
Organiske forbindelser
Mange organiske forbindelser indeholder ilt. Nogle af de klasser af organiske forbindelser, der indeholder ilt, er alkoholer, ethere, ketoner, aldehyder, carboxylsyrer, estere og amider. Mange organiske opløsningsmidler indeholder også ilt, f.eks. acetone, methanol og isopropanol. Ilt findes også i næsten alle biomolekyler, der fremstilles af levende væsener.
Oxygen reagerer også hurtigt med mange organiske forbindelser ved eller under stuetemperatur, når der sker autoxidation.
Industriel produktion
Hvert år hentes der 100 millioner tons O2 fra luften til industrielle formål. Industrierne bruger to hovedmetoder til at fremstille ilt. Den mest almindelige metode er fraktioneret destillation af flydende luft. N 2fordamper, mens O2 bliver tilbage som en væske. O2 er den næstvigtigste industrigas, og da det er mere økonomisk, opbevares og transporteres ilt normalt som en væske. En lille ståltank med et vandindhold på 16 liter og et arbejdstryk på 139 bar (2015 psi) rummer ca. 2150 liter gas og vejer 28 kg tomt. 2150 liter ilt vejer ca. 3 kg (6,6 lb).
Den anden hovedmetode til fremstilling af ilt er at lade en strøm af ren, tør luft passere gennem et par zeolitmolekylærsiver. Zeolittens molekylære sivene suger kvælstoffet op. Det giver en gasstrøm, der består af 90 % til 93 % ilt.
Iltgas kan også fremstilles ved elektrolyse af vand til molekylær ilt og brint.

Cykleren til højre indeholder flydende ilt.
Sikkerhed
Oxygen NFPA 704 siger, at komprimeret iltgas ikke er sundhedsfarligt og ikke er brandfarligt.
Toksicitet
Ved højt tryk kan iltgas (O2 ) være farlig for dyr, herunder mennesker, ved højt tryk. Den kan forårsage kramper og andre helbredsproblemer. Oxygenforgiftning begynder normalt at opstå ved tryk på over 50 kilopascal (kPa), hvilket svarer til ca. 50 % ilt i luften ved standardtryk (luft på Jorden indeholder ca. 20 % ilt).
Tidligere blev for tidligt fødte børn lagt i kasser med luft med et højt indhold af O2 . Dette blev stoppet, da nogle børn blev blinde af ilten.
Indånding af ren O2 i rumdragter forårsager ingen skade, fordi der anvendes et lavere tryk.
Forbrænding og andre farer
Koncentrerede mængder af ren O2 kan forårsage en hurtig brand. Når koncentreret ilt og brændsel bringes tæt sammen, kan en lille antændelse forårsage en enorm brand. Apollo 1-besætningen blev alle dræbt af en brand, fordi luften i kapslen havde et meget højt indhold af ilt.
Hvis flydende ilt spildes på organiske forbindelser som f.eks. træ, kan det eksplodere.
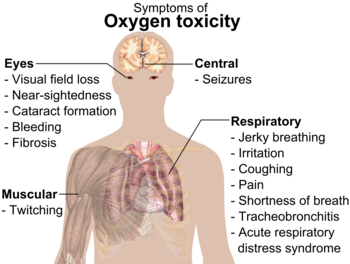
Symptomerne på iltforgiftning.
Relaterede sider
Spørgsmål og svar
Spørgsmål: Hvad er symbolet for ilt?
A: Symbolet for ilt er O.
Spørgsmål: Hvor mange iltatomer findes normalt i dioxygen (O2)?
Svar: Dioxygen (O2) indeholder typisk to oxygenatomer.
Spørgsmål: Hvilken farve har flydende eller fast ilt?
Svar: Flydende eller fast ilt er lyseblå i farven.
Spørgsmål: Hvilken gruppe i det periodiske system tilhører oxygen?
Svar: Oxygen tilhører chalcogen-gruppen i det periodiske system.
Spørgsmål: Hvor stor en del af Jordens atmosfære består af ilt i volumen?
Svar: Oxygen udgør mere end en femtedel af Jordens atmosfære i volumen.
Spørgsmål: Hvordan producerer planter og andre organismer det meste af jordens atmosfæriske ilt?
A: Planter og andre organismer producerer det meste af jordens atmosfæriske ilt gennem fotosyntese, som indebærer, at sollyset bruges til at omdanne vand til brint og frigiver ilt som et biprodukt.
Sp: Hvilke anvendelser har flydende eller størknet form af ilt?
A: Flydende eller størknet form af ilt kan anvendes som raketdrivmidler, til svejsning, til medicinske formål og til at trække vejret, når der ikke er god luft til rådighed (f.eks. dykkere og brandmænd).
Søge