Hvad er en syre? Definition, pH og stærke vs. svage syrer
Lær hvad en syre er: definition, pH-skalaen, og forskellen på stærke og svage syrer – enkel, faglig forklaring med eksempler og praktisk betydning.
Artiklen om visse egenskaber ved databaser findes på ACID
Nogle gange er syre et andet navn for stoffet LSD (Lysergic acid diethylamid)
En syre er et stof, der kan afgive en hydrogenion (H+) — ofte omtalt som en proton — til et andet stof. Denne definition svarer til Brønsted‑Lowry‑begrebet om syrer og baser: en syre er en protondonor, mens en base er en protonacceptor. Syrer findes både som uorganiske (fx saltsyre) og organiske (fx eddikesyre) forbindelser.
pH og hvad den fortæller
pH er et mål for koncentrationen af hydrogenioner i en opløsning og beregnes som pH = −log10[H+]. Skalaen går typisk fra ca. 0 til 14, hvor lave værdier (under 7) er sure, 7 er neutral (fx rent vand ved 25 °C) og høje værdier (over 7) er basiske. pH kan dog være lavere end 0 eller højere end 14 for meget stærke eller meget fortyndede opløsninger.
Forskellen mellem stærke og svage syrer
En vigtig forskel er, om et syremolekyle afgiver sin proton fuldstændigt eller kun delvist i vand:
- Stærke syrer dissocierer næsten fuldstændigt i vand — næsten hver molekyle afgiver sin proton. Eksempler på stærke uorganiske syrer er saltsyre (HCl), salpetersyre (HNO3) og svovlsyre (H2SO4). Stærke syrer har typisk meget lave pH‑værdier (ofte i området 1–3 ved almindelige koncentrationer), men pH afhænger også af koncentrationen.
- Svage syrer afgiver kun en del af deres protoner i ligevægt med deres konjugerede base — de ioniserer ikke fuldstændigt. Eksempler er eddikesyre (CH3COOH), kulsyre (H2CO3) og citronsyre. Svage syrer giver typisk pH i området omkring 4–6 ved mange almindelige koncentrationer, men dette kan variere.
Om en syre er stærk eller svag afhænger altså ikke kun af den målte pH, men af hvor stor en brøkdel af syremolekylerne der er dissocieret. Denne egenskab beskrives kvantitativt ved syrens dissociationskonstant Ka, eller ofte pKa (pKa = −log10 Ka). En stor Ka (lille pKa) betyder stærk syre; en lille Ka (stor pKa) betyder svag syre.
Konjugeret base og ligevægt
Syrereaktionen kan ofte skrives som HA ⇌ H+ + A−, hvor HA er syren og A− dens konjugerede base. For svage syrer ligger ligevægten til venstre (mange HA), for stærke syrer ligger den næsten helt til højre (mange H+ og A−).
Andre definitioner og relaterede begreber
Udover Brønsted‑Lowry findes Lewis‑begrebet: en Lewis‑syre er et stof, som kan acceptere et elektronpar (fx BF3 eller AlCl3), mens en Lewis‑base donerer et elektronpar. Denne definition omfatter flere forbindelser, der ikke nødvendigvis har et H‑atom at give væk.
En base er altså syres kemiske modsætning: baser accepterer protoner eller danner OH− i vandig opløsning. Når syrer og baser reagerer med hinanden, sker en neutralisation: syre + base → salt + vand.
Praktiske aspekter: koncentration, måling og sikkerhed
Det er vigtigt at skelne mellem styrke (evnen til at dissociere) og koncentration (mængde stof pr. volumen). En stærk syre i meget lav koncentration kan have højere pH end en svag syre i meget høj koncentration. pH måles typisk med en pH‑meter eller med indikatorer (fx lakmus, som viser rød i syre og blå i base).
Syrer kan være ætsende og farlige — især stærke mineral‑syrer. Brug passende værnemidler (handsker, beskyttelsesbriller) og fortynd altid syre ved at tilsætte syren langsomt til vand (ikke omvendt) for at undgå kraftig varmeudvikling.
Kort sagt: en syre er et protondonerende stof; pH angiver, hvor sur en opløsning er; og forskellen mellem stærke og svage syrer handler om, hvor fuldstændigt de afgiver deres protoner (Ka/pKa). For uddybning af relaterede emner kan du se artiklerne om pH‑værdier, oxygen, nitrogen, klor samt om stærke og svage syrer.

Saltsyre (i bægerglas) reagerer med ammoniakdampene og danner ammoniumchlorid (hvid røg).
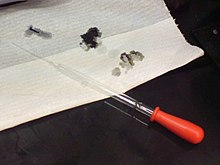
Syrer kan være farlige: Hullerne i papiret blev lavet af en opløsning med 98% svovlsyre.
Sådan virker syrer
Syrer og baser eksisterer typisk sammen i ligevægt. Det betyder, at i en prøve af en syre vil nogle molekyler afgive deres protoner, og andre vil acceptere dem. Selv vand er en blanding af en sur ion, H3 O+ (kaldet en hydroniumion), og en basisk ion, OH- (kaldet en hydroxidion). En hydroniumion afgiver sin proton til en hydroxidion og danner to molekyler H 2O, som er neutralt. Denne reaktion sker løbende i en vandprøve, men generelt er prøven neutral, fordi der er lige store mængder hydronium og hydroxid i prøven. I de fleste reaktioner er syrer og baser imidlertid ikke til stede i lige store mængder, og det er denne ubalance, der gør det muligt for en kemisk reaktion at finde sted.
Enhver syre har en konjugeret base, der dannes ved at fjerne syrens proton. Saltsyre (HCl) er f.eks. en syre, og dens konjugerede base er en kloranion eller Cl-. En syre og dens konjugerede base er modsat stærke. Da HCl er en stærk syre, er Cl -en svag base.
Egenskaber
Syrer kan have forskellig styrke, nogle er mere reaktive end andre. Mere reaktive syrer er ofte farligere.
Syrer kan have mange forskellige egenskaber afhængigt af deres molekylære struktur. De fleste syrer har følgende egenskaber:
- smager surt, når de spises
- kan stikke i huden, når de berøres
- kan ætse (eller æde) metaller og hud
- kan anvendes som reaktant under elektrolyse på grund af tilstedeværelsen af mobile ioner
- gør blåt lakmuspapir rødt
- bliver rød eller orange på universalindikatoren
- lede elektricitet
Syrer kan forbrænde huden, og hvor alvorlig forbrændingen er, afhænger af syrens type og koncentration. Disse kemiske forbrændinger kræver øjeblikkelig lægehjælp.
Fordi syrer afgiver hydrogenioner, skal alle syrer indeholde hydrogen.

Advarselsbillede anvendes sammen med farlige syrer og farlige baser. Baser er det modsatte af syrer.
Vigtighed
Syrer er vigtige. Nukleinsyrer, såsom DNA og RNA, indeholder den genetiske kode. Disse molekyler bestemmer mange af en organismes egenskaber, og de overføres fra forældrene til afkommet. DNA indeholder planerne for, hvordan man opbygger proteiner, som er lavet af aminosyrer.
Fedtsyrer og fedtsyrederivater er en anden gruppe af carboxylsyrer, der spiller en vigtig rolle i biologien. De indeholder lange kæder af kulbrinter og en carboxylsyregruppe i den ene ende. Cellemembranen i næsten alle organismer består primært af et fosfolipid-dobbeltlag, en micelle af hydrofobiske fedtsyrekæder med polære, hydrofile fosfat-"hoved"-grupper.
Hos mennesker og mange andre dyr er saltsyre en del af den mavesyre, der udskilles i mavesækken. Den kan hjælpe med at hydrolyse proteiner og polysaccharider. Den kan også omdanne det inaktive pro-enzym pepsinogen til enzymet pepsin. Nogle organismer producerer syrer til forsvar; for eksempel producerer myrer myresyre, og blæksprutter producerer en sort syre kaldet magneta.
De fleste syrer findes i naturen. Nogle af disse omfatter følgende:
- Eddike er nok en af de mest kendte; den indeholder eddikesyre, som giver den sin velkendte smag.
- Salpetersyre, NHO,3 har været kendt siden omkring det 13. århundrede.
- Citronsyre, C6 H8 O7, findes i mange slags frugt. De blev sandsynligvis opdaget af Geber i det 8. århundrede.
- Mælkesyre, C3 H6 O3, blev fundet af Carl Wilhelm Scheele i 1780. Den findes i surmælksprodukter som f.eks. yoghurt.
- Svovlsyre, H2 SO4, blev sandsynligvis opdaget af Geber. I dag findes den i batterier.
Relaterede sider
- Alkali
- Folinsyre
Spørgsmål og svar
Spørgsmål: Hvad er syre?
A: ACID er en artikel om visse egenskaber ved databaser.
Q: Hvad er syre i almindelighed?
A: Syre generelt er et stof, der kan afgive en hydrogenion (H+) til et andet stof, med en pH-værdi på under 7,0.
Sp: Under hvilke betingelser kan et kemikalie afgive en proton?
Svar: Et kemisk stof kan afgive en proton, hvis hydrogenatomet er knyttet til et elektronegativt atom som f.eks. oxygen, nitrogen eller klor.
Spørgsmål: Hvad er forskellen mellem stærke syrer og svage syrer?
Svar: Stærke syrer giver slip på alle deres protoner, mens svage syrer holder fast i nogle af dem. Det er mængden af ioner, der frigives pr. molekyle, der afgør, om syren er svag eller stærk.
Spørgsmål: Hvad er pH-området for svage og stærke syrer?
Svar: Svage syrer har generelt en pH-værdi på 4-6, mens stærke syrer har en pH-værdi på 1-3.
Spørgsmål: Hvad er en base?
Svar: En base er en syres "kemiske modsætning". En base er et stof, der vil acceptere syrens hydrogenatom. Baser er molekyler, der kan splittes i vand og frigive hydroxidioner.
Sp: Hvad er LSD?
Svar: LSD (Lysergic acid diethylamid) er et stof, der nogle gange omtales som syre, men det er ikke relateret til den syre, der er nævnt i denne artikel.
Søge