Atom | den mest grundlæggende enhed af stof
Et atom er den mest grundlæggende enhed i stof. Alt normalt stof på jorden og overalt i universet består af atomer. Dette omfatter faste stoffer, væsker og gasser. Der findes et fast antal forskellige typer af atomer, kaldet kemiske grundstoffer. Et atom er den mindste stofenhed, der kan kombineres med andre atomer for at danne molekyler og mere komplekse stoffer, der har specifikke kemiske egenskaber.
Atomer er meget små, men deres nøjagtige størrelse afhænger af typen. Atomer er mellem 0,1 og 0,5 nanometer store. En nanometer er ca. 100 000 gange mindre end bredden på et menneskehår. Det gør det umuligt at se et atom uden specialværktøj. Forskere finder ud af, hvordan de fungerer, ved at lave eksperimenter.
Atomer består af tre typer af subatomare partikler. Disse er protoner, neutroner og elektroner. Protoner og neutroner er tungere og befinder sig i midten af atomet, som kaldes kernen. Atomkernen er meget lille og tæt. Den er omgivet af letvægtige elektroner. Elektronerne tiltrækkes til kernen af den elektromagnetiske kraft, fordi de har modsatrettede elektriske ladninger.
Atomer med det samme antal protoner er det samme kemiske grundstof. De har meget ensartede egenskaber. Eksempler på grundstoffer er brint og guld. Der findes ca. 92 grundstoffer i naturen. (Flere er blevet fremstillet kunstigt i et laboratorium). Atomer med samme antal protoner, men forskelligt antal neutroner, kaldes isotoper. Normalt har et atom det samme antal elektroner som protoner. Hvis et atom har flere eller færre elektroner end protoner, kaldes det en ion og har en elektrisk ladning.
Mange ting består af mere end én type atom. Det er kemiske forbindelser eller blandinger. Atomer kan forbindes ved at lave kemiske bindinger. En gruppe af atomer, der er forbundet med kemiske bindinger, kaldes et molekyle. Et vandmolekyle består f.eks. af to hydrogenatomer og et oxygenatom.
Det er sjældent, at atomerne bliver skabt, ødelagt eller ændret til en anden type atom. Det sker, hvis de indre kræfter er for svage til at holde dem sammen. Disse ændringer studeres i kernefysik. Atomer kan også slutte sig sammen til større atomer ved meget høje temperaturer, som f.eks. inde i en stjerne.
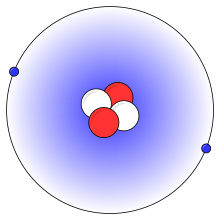
Et forenklet billede af et heliumatom med to protoner (rød), to neutroner (hvid) og to elektroner (blå)
Historie
Ordet "atom" kommer af græsk (ἀτόμος) "atomos", udelelig, af (ἀ)-, ikke, og τόμος, et snit. Den første person, vi ved, der brugte ordet "atom", er den græske filosof Demokrit omkring 400 f.Kr. Han mente, at alt var lavet af atomer, og atomer ikke kunne brydes i mindre stykker. Atomteorien var oprindeligt et filosofisk emne, som ikke blev undersøgt eller studeret videnskabeligt, før udviklingen af kemien i 1650'erne.
I 1777 definerede den franske kemiker Antoine Lavoisier for første gang begrebet grundstof. Han sagde, at et grundstof var ethvert grundstof, som ikke kunne nedbrydes til andre stoffer ved hjælp af kemiske metoder. Ethvert stof, der kunne nedbrydes, var en forbindelse.
I 1803 foreslog den engelske filosof John Dalton, at grundstofferne bestod af små, faste kugler kaldet atomer. Dalton mente, at alle atomer af det samme grundstof har samme masse. Han sagde, at forbindelser dannes, når atomer af mere end ét grundstof kombineres. Ifølge Dalton kombineres atomerne i en bestemt forbindelse altid på samme måde i en bestemt forbindelse.
I 1827 kiggede den britiske videnskabsmand Robert Brown på pollenkorn i vand under sit mikroskop. Pollenkornene så ud til at ryste rundt. Brown brugte Daltons atomteori til at beskrive mønstre i deres bevægelse. Dette blev kaldt Brownsk bevægelse. I 1905 brugte Albert Einstein matematikken til at bevise, at pollenpartiklerne blev bevæget af bevægelsen eller varmen fra de enkelte vandmolekyler. Dermed beviste han endegyldigt atomets eksistens. I 1869 offentliggjorde den russiske videnskabsmand Dmitri Mendelejev den første version af det periodiske system. Det periodiske system grupperer grundstofferne efter deres atomnummer (hvor mange protoner de har; dette er normalt det samme som antallet af elektroner). Grundstoffer i samme kolonne, eller periode, har normalt de samme egenskaber. F.eks. er helium, neon, argon, krypton og xenon alle i samme kolonne og har meget ensartede egenskaber. Alle disse grundstoffer er gasser, der hverken har farve eller lugt. De er heller ikke i stand til at kombinere sig med andre atomer for at danne forbindelser. Sammen er de kendt som ædelgasserne.
Fysikeren J.J. Thomson var den første, der opdagede elektroner. Det skete, mens han arbejdede med katodestråler i 1897. Han indså, at de havde en negativ ladning, og at atomkernen havde en positiv ladning. Thomson lavede plum pudding-modellen, som sagde, at et atom var som plum pudding: den tørrede frugt (elektroner) sad fast i en masse af pudding (som har en positiv ladning). I 1909 brugte en videnskabsmand ved navn Ernest Rutherford Geiger-Marsden-eksperimentet til at bevise, at det meste af et atom befinder sig i et meget lille rum, atomkernen. Rutherford tog en fotoplade og dækkede den med guldfolie. Derefter skød han alfapartikler (bestående af to protoner og to neutroner, der sidder fast sammen) mod den. Mange af partiklerne gik gennem guldfolien, hvilket beviste, at atomerne for det meste består af tomt rum. Elektroner er så små og hurtigt bevægelige, at de ikke forhindrede partiklerne i at gå igennem. Rutherford opdagede senere protoner i kernen.
I 1913 introducerede Niels Bohr Bohr-modellen. Denne model viste, at elektronerne bevæger sig rundt om kernen i faste cirkulære baner. Den var mere præcis end Rutherford-modellen. Den var dog stadig ikke helt korrekt. Der er blevet foretaget forbedringer af Bohr-modellen, efter at den blev introduceret første gang.
I 1925 opdagede kemiker Frederick Soddy, at nogle grundstoffer i det periodiske system havde mere end ét slags atom, kaldet isotoper. Soddy mente, at isotoper af et grundstof har forskellig masse. For at bevise dette byggede kemiker Francis W. Aston massespektrometeret, som måler massen af de enkelte atomer. Aston beviste, at Soddy havde ret. Han fandt også ud af, at massen af hvert atom er et helt tal gange protonens masse. Det betød, at der må være en anden partikel i kernen end protoner. I 1932 skød fysikeren James Chadwick alfapartikler mod berylliumatomer. Han så, at en partikel skød ud af berylliumatomerne. Denne partikel var uden ladning, men havde omtrent samme masse som en proton. Han kaldte denne partikel for neutronen.
Den hidtil mest præcise model stammer fra Schrödinger-ligningen. Schrödinger fandt ud af, at elektronerne findes i en sky omkring kernen, kaldet elektronskyen. I elektronskyen er det umuligt at vide præcis, hvor elektronerne befinder sig. Schrödinger-ligningen bruges til at bestemme, hvor en elektron sandsynligvis vil befinde sig. Dette område kaldes elektronens omløbsbane.
I 1937 blev den tyske kemiker Otto Hahn den første til at lave kernespaltning i et laboratorium. Han opdagede dette ved et tilfælde, da han skød neutroner mod et uranatom i håb om at lave en ny isotop. Han bemærkede imidlertid, at uranatomet i stedet for en ny isotop blev ændret til et bariumatom, et mindre atom end uran. Hahn havde "knækket" uranatomet. Dette var verdens første registrerede kernespaltningsreaktion. Denne opdagelse førte i sidste ende til skabelsen af atombomben og atomkraft, hvor fission sker gentagne gange og skaber en kædereaktion.
I det 20. århundrede gik fysikerne endnu dybere ind i atomets mysterier. Ved hjælp af partikelacceleratorer opdagede de, at protoner og neutroner var lavet af andre partikler, kaldet kvarker.
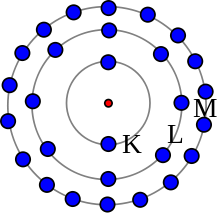
Bohr-modellen er ikke nøjagtig, men den er nyttig til at forstå tanken om elektronskaller. Dette atom har 28 elektroner i tre skaller.
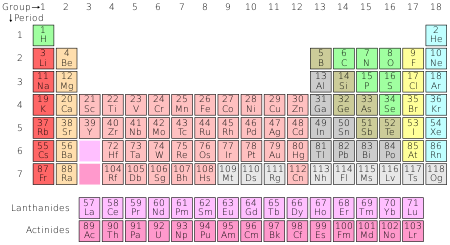
Det periodiske system organiserer alle kendte kemiske grundstoffer.

Ernest Rutherford
Klassifikation
Antallet af protoner i et atom kaldes atomnummeret. Atomer af det samme grundstof har samme atomnummer. For eksempel har alle kulstofatomer seks protoner, så kulstofs atomnummer er seks. I dag er der 118 grundstoffer kendt. Afhængigt af hvordan tallet tælles, findes der 90 til 94 grundstoffer naturligt på jorden. Alle grundstoffer over nummer 94 er kun blevet fremstillet af mennesker. Disse grundstoffer er organiseret i det periodiske system.
Fordi protoner og neutroner har meget ens masse, og elektronernes masse er meget lille, kan vi kalde antallet af protoner og neutroner i et atom for dets massetal. De fleste grundstoffer har flere isotoper med forskellige massetal. For at navngive en isotop bruger vi grundstoffets navn efterfulgt af dets massetal. Et atom med seks protoner og syv neutroner kaldes således carbon-13. Den gennemsnitlige masse af alle atomer af et bestemt grundstof kaldes dets atommasse eller atomvægt.
Hvis protonerne, neutronerne eller elektronerne i et atom udskiftes med andre partikler, kan man lave eksotiske atomer. Eksperimenter har vist, at enhver partikel har en modsætning, en såkaldt antipartikel. Tilsammen udgør disse partikler antimaterie. Et antimaterieatom ville være lavet af antiprotoner, antineutroner og antielektroner (positroner). Når en partikel møder sin antipartikel, bliver de begge ødelagt. Bortset fra det kan antimaterieatomer være meget lig normale atomer.
Opbygning og dele
Dele
Et atom består af tre hovedpartikler: proton, neutron og elektron. Hydrogen-1, en isotop af hydrogen, har ingen neutroner, kun en proton og en elektron. En positiv brintion har ingen elektroner og kun én proton. Alle andre atomer har mindst én proton, én neutron og én elektron hver.
Elektroner er langt den mindste af de tre atomare partikler. Deres størrelse er for lille til at kunne måles med den nuværende teknologi, og deres masse er ca. 9,1×10−28 gram (0,00055 atomare masseenheder). De har en negativ ladning. Protoner og neutroner har samme størrelse og vægt som hinanden og har en masse på ca. 1,7×10−24 gram (1 atommassenhed). Protoner har en positiv ladning, og neutroner har ingen ladning. De fleste atomer har en neutral ladning. Antallet af protoner (positive) og elektroner (negative) er det samme, så ladningerne udligner sig til nul. I ioner (forskelligt antal elektroner) er dette dog ikke tilfældet, og de kan have en positiv eller negativ ladning. Protoner og neutroner består af kvarker af to typer: op- og nedadgående kvarker. En proton består af to op-kvarker og en ned-kvark, og en neutron består af to ned-kvarker og en op-kvark.
Nucleus
Atomkernen befinder sig i midten af et atom. Den udgør mere end 99,9 % af atomets masse. Den er imidlertid meget lille: ca. 1 femtometer (10−15 m) på tværs, hvilket er ca. 100 000 gange mindre end bredden af et atom, så den har en meget høj massefylde. Den består af protoner og neutroner. I naturen er det normalt sådan, at to ting med samme ladning frastøder hinanden eller skyder væk fra hinanden. Så i lang tid vidste forskerne ikke, hvordan de positivt ladede protoner i kernen holdt sammen. Vi mener nu, at tiltrækningen mellem protoner og neutroner skyldes den stærke vekselvirkning.
Den stærke vekselvirkning er stærkest over en meget kort afstand. På denne afstand bæres den af en partikel, der kaldes en gluon. Gluoner virker som lim, der klistrer kvarker sammen i en proton eller neutron. Over en længere afstand er den stærke vekselvirkning svagere. Den bæres af en partikel, der kaldes en meson. Mesoner tiltrækker protoner og neutroner ved hjælp af den stærke vekselvirkning. De holder kernen sammen. Denne særlige form for den stærke vekselvirkning kaldes kernekraften.
Antallet af neutroner i forhold til antallet af protoner er afgørende for, om kernen er stabil eller om den radioaktivt henfalder. Når der er for mange neutroner eller protoner, forsøger atomet at gøre antallet mindre eller mere ligeligt ved at fjerne de ekstra partikler. Det gør det ved at udsende stråling i form af alfa-, beta- eller gammahenfald. Atomkerner kan også ændre sig på andre måder. Ved kernespaltning spaltes kernen i to mindre kerner, hvorved der frigives en masse energi. Det er denne frigivelse af energi, der gør kernespaltning nyttig til fremstilling af bomber og elektricitet i form af kernekraft. Den anden måde, kerner kan ændre sig på, er ved kernefusion, når to atomkerner smelter sammen eller smelter sammen til en større kerne. Denne proces kræver ekstreme mængder energi for at overvinde den elektrostatiske frastødning mellem protonerne, da de har den samme ladning. Sådanne høje energier er mest almindelige i stjerner som vores sol, der fusionerer brint til brændstof. Når fusionen først er sket, frigøres der imidlertid langt mere energi, fordi en del af massen omdannes til energi.
Elektroner
Elektroner kredser om kernen, eller bevæger sig rundt om den. De kaldes atomets elektronsky. De tiltrækkes af kernen på grund af den elektromagnetiske kraft. Elektroner har en negativ ladning, og kernen har altid en positiv ladning, så de tiltrækkes af hinanden.
Ifølge Bohr-modellen er nogle elektroner længere væk fra kernen end andre i forskellige lag. Disse lag kaldes elektronskaller. Vi har lært, at kun elektronerne i den yderste skal kan lave kemiske bindinger. Antallet af elektroner i den yderste skal bestemmer, om et atom er stabilt, eller hvilke atomer det vil binde sig til i en kemisk reaktion. Hvis et atom kun har én skal, skal det have to elektroner for at være komplet. Ellers skal den yderste skal have otte elektroner for at være komplet.
Bohr-modellen er vigtig, fordi den indeholder idéen om energiniveauer. Elektronerne i hver skal har en bestemt mængde energi. De skaller, der er længere væk fra kernen, har mere energi. Når en lille energiudladning, kaldet en foton, rammer en elektron, kan elektronen hoppe over i en højere energiskal. Denne foton skal bære præcis den rette mængde energi for at bringe elektronen til det nye energiniveau. En foton er et lysbrag, og energimængden bestemmer lysets farve. Så hver type atom vil absorbere bestemte farver af lys, kaldet absorptionsspektret. En elektron kan også sende en foton ud, eller emittere en foton, og falde ind i en lavere energiskal. Af samme grund vil et atom kun udsende visse farver af lys, kaldet emissionsspektret.
Det samlede billede er mere kompliceret. I modsætning til Jorden, der bevæger sig rundt om Solen, bevæger elektroner sig ikke i en cirkel. Vi kan ikke vide, hvor en elektron befinder sig nøjagtigt. Vi kender kun sandsynligheden for, eller chancen for, at den befinder sig et hvilket som helst sted. Hver elektron er en del af en bane, som beskriver, hvor den sandsynligvis vil være. Der kan højst være to elektroner i en orbital; disse to elektroner har forskelligt spin.
For hver skal, der er nummereret 1, 2, 3 osv., kan der være flere orbitaler med forskellige former. Orbitaltyperne er angivet med bogstaver: s, p, d og f. Der kan også være flere orbitaler for én tal- og bogstavkombination. Når der tilføjes flere elektroner, slutter de sig til orbitalerne i rækkefølge fra laveste til højeste energi. Denne rækkefølge starter som følger: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d. Et kloratom har f.eks. 17 elektroner. Det vil således have 2 elektroner i 1s-bobitalet, 2 elektroner i 2s-bobitalet, 6 elektroner i 2p-bobitalet, 2 elektroner i 3s-bobitalet og 5 elektroner i 3p-bobitalet. Med andre ord har den 2 elektroner i den første skal, 8 i den anden skal og 7 i den tredje skal.

De forskellige orbitalers form omkring et atom
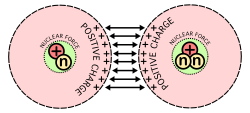
Et billede, der viser den største vanskelighed ved kernefusion: Protoner, som har positive ladninger, frastøder hinanden, når de tvinges sammen.
Egenskaber
Størrelse og masse
Størrelsen af et atom afhænger af størrelsen af dets elektronsky. Når man bevæger sig nedad i det periodiske system, tilføjes der flere elektronskaller. Som følge heraf bliver atomerne større. Hvis man bevæger sig mod højre i det periodiske system, tilføjes der flere protoner til kernen. Der tilføjes dog ingen elektronskaller. Denne mere positive kerne trækker elektroner stærkere til sig, så atomerne bliver mindre. Det største atom er cæsium, som ifølge en model er ca. 0,596 nanometer bredt. Det mindste atom er helium, som er ca. 0,062 nanometer bredt.
Atomer har en masse på mellem 1,7×10−24 og 4,9×10 −22gram. Normalt måles massen ved hjælp af den atomare masseenhed (amu), også kaldet dalton. En amu er præcis 1/12 af massen af et kulstof-12-atom, som er 1,7×10−24 gram. Hydrogen-1 har en masse på ca. 1 amu, og det tungeste kendte atom, oganesson, har en masse på ca. 294 amu.
Hvordan atomer interagerer
Når atomerne er langt fra hinanden, tiltrækkes de af hinanden. Denne tiltrækning er stærkere for nogle slags atomer end for andre. Samtidig får atomernes varme, eller kinetiske energi, dem til at bevæge sig konstant. Hvis tiltrækningen er stærk nok i forhold til varmemængden, vil atomerne danne et fast stof. Hvis tiltrækningen er svagere, vil de danne en væske, og hvis den er endnu svagere, vil de danne en gas.
Kemiske bindinger er de stærkeste former for tiltrækning mellem atomer. Alle kemiske bindinger involverer bevægelse af elektroner. Atomer binder sig normalt til hinanden på en måde, der fylder eller tømmer deres ydre elektronskal. De mest reaktive grundstoffer skal miste eller få et lille antal elektroner for at have en fuld ydre skal. Atomer med en fuld ydre skal, kaldet ædelgasser, danner normalt ikke bindinger.
Der findes tre hovedtyper af bindinger: ionbindinger, kovalente bindinger og metalbindinger.
- I en ionisk binding giver et atom elektroner til et andet atom. Hvert atom bliver til en ion: et atom eller en gruppe af atomer med en positiv eller negativ ladning. Den positive ion (som har mistet elektroner) kaldes et kation; det er normalt et metal. Den negative ion (som har fået elektroner) kaldes en anion; det er normalt et ikke-metal. Ionisk binding resulterer normalt i et gitter eller en krystal af ioner, der holdes sammen.
- I en kovalent binding deler to atomer elektroner. Dette sker normalt, når begge atomer er ikke-metaller. Kovalente bindinger danner ofte molekyler, der varierer i størrelse fra to atomer til mange flere. De kan også danne store netværk, som f.eks. glas eller grafit. Antallet af bindinger, som et atom indgår (dets valens), er normalt det antal elektroner, der er nødvendige for at fylde dets ydre elektronskal.
- I en metalbinding bevæger elektronerne sig frit mellem mange metalatomer. Et vilkårligt antal atomer kan bindes på denne måde. Metaller leder elektrisk strøm, fordi elektrisk ladning let kan strømme gennem dem. Atomer i metaller kan bevæge sig forbi hinanden, så det er let at bøje, strække og omforme metaller.
Alle atomer tiltrækker hinanden ved Van der Waals-kræfter, som er svagere end kemiske bindinger. Disse kræfter opstår, når elektroner flytter sig til den ene side af et atom. Denne bevægelse giver en negativ ladning til denne side. Den giver også en positiv ladning til den anden side. Når to atomer stiller deres sider med negativ og positiv ladning på linje, vil de tiltrække hinanden.
Selv om det meste af rummet er tomt, kan atomerne ikke passere gennem hinanden. Når to atomer er meget tæt på hinanden, vil deres elektronskyer frastøde hinanden ved hjælp af den elektromagnetiske kraft.
Magnetisme
En elektron har en egenskab, der kaldes et magnetisk moment, som har en retning og en størrelse (eller størrelse). Det magnetiske moment stammer fra elektronens individuelle spin og dens kredsløb om kernen. Tilsammen udgør elektronernes magnetiske moment et magnetisk moment for hele atomet. Dette forklarer atomernes opførsel i et magnetfelt.
Hver elektron i et atom har en af to slags spin. Hvis hver elektron er parret med en elektron med modsat spin, vil spinnene ophæve hinanden, så atomet vil ikke have noget vedvarende magnetisk moment. Atomer som dette kaldes diamagnetiske: de bliver kun svagt frastødt af et magnetfelt.
Men hvis nogle elektroner ikke er parret, vil atomet have et vedvarende magnetisk moment: det vil være paramagnetisk eller ferromagnetisk. Når atomer er paramagnetiske, peger det magnetiske moment for hvert atom i en tilfældig retning. De er svagt tiltrukket af et magnetfelt. Når atomer er ferromagnetiske, virker de magnetiske momenter fra nærliggende atomer på hinanden. De peger i samme retning. I et magnetfelt vil de fleste atomer stille sig på linje i feltets retning. Ferromagnetiske materialer som jern, kobolt og nikkel tiltrækkes stærkt af et magnetfelt.
Radioaktivt henfald
Nogle grundstoffer og mange isotoper har det, der kaldes en ustabil kerne. Det betyder, at kernen enten er for stor til at holde sammen på sig selv eller har for mange protoner eller neutroner. Når dette sker, skal kernen fjerne den overskydende masse af partikler. Det gør den ved hjælp af stråling. Et atom, der gør dette, kan kaldes radioaktivt. Ustabile atomer udsender stråling, indtil de mister nok partikler i kernen til at blive stabile. Alle atomer over atomnummer 82 (82 protoner, bly) er radioaktive.
Der er tre hovedtyper af radioaktivt henfald: alfa, beta og gamma.
- Ved alfatiske henfald udsender et atom en partikel med to protoner og to neutroner. Dette er i princippet en heliumkerne. Resultatet er et grundstof med et atomnummer to mindre end tidligere. Så hvis et berylliumatom (atomnummer 4) f.eks. gennemgik alfahenfald, ville det blive til helium (atomnummer 2). Alfaforfald sker, når et atom er for stort og har brug for at slippe af med noget masse.
- Beta-fald er, når en neutron bliver til en proton, eller en proton bliver til en neutron. I det første tilfælde skyder atomet en elektron ud. I det andet tilfælde er det en positron (ligesom en elektron, men med positiv ladning). Resultatet er et grundstof med et højere eller et lavere atomnummer end før. Beta-henfald sker, når et atom enten har for mange protoner eller for mange neutroner.
- Gammahenfald er, når et atom udsender en gammastråle eller en bølge. Det sker, når der sker en ændring i kerneenergien i kernen. Dette sker normalt efter at en kerne har gennemgået alfa- eller beta-henfald. Der sker ingen ændring i atomets masse eller atomnummer, kun i den lagrede energi inde i kernen i form af partikelspin.
Alle radioaktive grundstoffer eller isotoper har en halveringstid. Det er den tid, det tager halvdelen af en prøve af atomer af den pågældende type at henfalde, indtil de bliver til en anden isotop eller et andet grundstof.
Spaltning og fusion
Anordninger, der anvender kernespaltning, starter med at skyde neutroner på atomer. Dette får atomerne til at gå hurtigt i stykker. Spaltningen af et atom affyrer flere neutroner, som derefter splitter andre atomer og skaber kædereaktioner. Denne proces giver enorme mængder varmeenergi. Kædereaktionen ved spaltning drev de første atomvåben (fissionsbomber). Atomkraftværker er lidt anderledes: Der bruges ting, der kaldes kontrolstave, til at bremse fissionerne. Kontrolstængerne opsamler nogle af neutronerne, hvilket forhindrer en kædereaktion i at finde sted.
Kernefusion forekommer mest i Solen og andre stjerner. Den kræver et varmt sted, men giver endnu mere energi end fission. Det forklarer solens varme og lys. Solen fusionerer nu brint til helium, mens større og varmere stjerner laver tungere atomer. Fusionsbomber, eller termonukleare våben, er de kraftigste atomvåben. Forskere forsøger at lave fusionsreaktorer til atomkraftværker, men der findes endnu ingen.
Kernefusion og kernespaltning producerer energi af samme årsager. I henhold til Einsteins berømte formel E = mc2 kan en lille mængde masse omdannes til en stor mængde energi. Når protoner og neutroner mødes ved kernefusion, mister de en del masse, som de sender ud som energi. Kernen kan kun splittes op i sine protoner og neutroner, hvis der tilføres den samme mængde energi. Denne egenskab ved hver type kerne kaldes dens nukleare bindingsenergi. Fusion eller fission udsender energi, hvis den samlede bindingsenergi øges. Kerner i intervallet jern-56 og nikkel-62 har den højeste bindingsenergi divideret med deres antal protoner og neutroner, så de gennemgår generelt ikke fission eller fusion. Større atomer, som f.eks. uran, gennemgår kernespaltning, fordi det øger deres bindingsenergi.
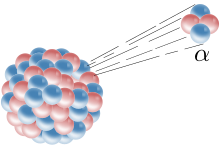
En alfapartikel skyder ud af en kerne.
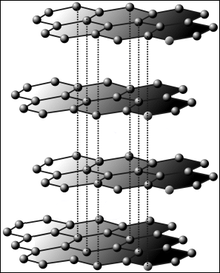
Grafit består af kulstofatomer i lag. Hvert lag holdes sammen af kovalente bindinger. Tiltrækningen mellem de forskellige lag er en Van der Waals-kraft.
Dannelse og forekomst
Næsten alle hydrogenatomer i universet, de fleste heliumatomer og nogle af lithiumatomerne blev dannet kort efter Big Bang. Selv i dag er ca. 90 % af alle atomer i universet brint. Større atomer dannes i stjerner ved kernefusion, mens de største atomer dannes i meget massive stjerner eller supernovaer. De fleste atomer på Jorden blev skabt af en stjerne, der eksisterede før Solen.
Man laver meget store atomer ved at smadre mindre atomer sammen i partikelacceleratorer. Disse atomer henfalder dog ofte meget hurtigt. Oganesson (grundstof 118) har en halveringstid på 0,89 millisekunder. Det er muligt, at der i fremtiden vil blive skabt endnu større atomer.
Relaterede sider
- Atomfysik, for mere detaljeret information om atomernes fysik
- Kemi, det område, der studerer alle ting, der er lavet af atomer
- Elementarpartikler, de partikler, der udgør atomer og alt andet
- Kvantemekanik, studiet af små partikler og deres samspil med energi
- stoftilstande, de forskellige former, som atomer eller molekyler kan findes i
Spørgsmål og svar
Spørgsmål: Hvad er et atom?
A: Et atom er den mest grundlæggende enhed af stof. Det er den mindste stofenhed, der kan kombineres med andre atomer for at danne molekyler og mere komplekse stoffer, der har specifikke kemiske egenskaber.
Spørgsmål: Hvor store er atomer?
A: Atomer er meget små, fra 0,1 til 0,5 nanometer, hvilket er ca. 100.000 gange mindre end bredden af et menneskehår.
Spørgsmål: Hvilke tre typer subatomare partikler udgør et atom?
Svar: De tre typer subatomare partikler, der udgør et atom, er protoner, neutroner og elektroner. Protoner og neutroner er tungere og befinder sig i kernen, mens elektroner er lettere og tiltrækkes til kernen af elektromagnetisk kraft på grund af deres modsatte elektriske ladninger.
Spørgsmål: Hvor mange grundstoffer findes naturligt i verden?
Svar: Der findes ca. 92 grundstoffer naturligt i verden.
Spørgsmål: Hvad sker der, når et atom har flere eller færre elektroner end protoner?
Svar: Hvis et atom har flere eller færre elektroner end protoner, kaldes det en ion og har en elektrisk ladning.
Spørgsmål: Hvilken type ændringer sker der, hvis kræfterne i atomerne bliver for svage til at holde dem sammen?
Svar: Hvis kræfterne inden i atomerne bliver for svage til at holde dem sammen, kan de ændres til en anden type atom eller helt ødelægges; denne proces studeres i kernefysikken.
Søge