Det periodiske system: Oversigt over grundstoffer, perioder og grupper
Komplet guide til det periodiske system: forstå grundstoffer, perioder, grupper, kemiske egenskaber og IUPAC-systemet – overskuelig forklaring for studerende og nysgerrige.
Det periodiske system over de kemiske grundstoffer er en liste over kendte kemiske grundstoffer. I tabellen er grundstofferne placeret i rækkefølge efter deres atomnummer, idet de begynder med det laveste nummer et, hydrogen. Atomnummeret for et grundstof er det samme som antallet af protoner i den pågældende atomkerne i et atom. I det periodiske system er grundstofferne inddelt i perioder og grupper. En række af grundstoffer på tværs af bordet kaldes en periode. Hver periode har et nummer; fra 1 til 8. Periode 1 indeholder kun 2 grundstoffer: brint og helium. Periode 2 og periode 3 har begge 8 grundstoffer. Andre perioder er længere. Elementer i en periode har på hinanden følgende atomnumre.
En kolonne af elementer nedad i tabellen kaldes en gruppe. Der er 18 grupper i det periodiske system. Hver gruppe har et nummer: fra 1 til 18. Grundstoffer i en gruppe har elektroner arrangeret på lignende måder, alt efter antallet af valenselektroner, hvilket giver dem lignende kemiske egenskaber (de opfører sig på samme måde). F.eks. er gruppe 18 kendt som ædelgasserne, fordi de alle er gasser, og fordi de ikke kombinerer sig med andre atomer.
Der findes to systemer for gruppetal: et med arabiske tal (1,2,3) og et med romertal (I, II, III). De romertal blev anvendt i det meste af det 20. århundrede. I 1990 besluttede Den Internationale Union for Ren og Anvendt Kemi (IUPAC) at anvende det nye system med arabiske tal i stedet for de to gamle gruppesystemer, hvor der blev anvendt romertal.
Det periodiske system er blevet brugt af kemikere til at observere mønstre og relationer mellem grundstoffer. Der er 3 hovedgrupper i det periodiske system: metaller, metalloider og ikke-metaller. For eksempel er grundstofferne nederst og længst til venstre i tabellen de mest metalliske, og grundstofferne øverst til højre er de mindst metalliske. (f.eks. er cæsium meget mere metallisk end helium). Der findes også mange andre mønstre og relationer.
Det periodiske system blev opfundet af den russiske kemiker Dmitry Ivanovich Mendeleyev (1834-1907). Til hans ære blev grundstof 101 opkaldt efter ham, mendelevium.
Hvordan tabellen læses og hvad hvert felt viser
Hvert felt i tabellen viser typisk grundstoffets kemiske symbol (f.eks. H for brint), dets atomnummer (antal protoner) og ofte dets atommasse (gennemsnitlig masse af naturligt forekommende isotoper). Atomnummeret bestemmer grundstoffets identitet, mens atommassen afspejler isotopsammensætningen. Isotoper er varianter af et grundstof med samme antal protoner, men forskelligt antal neutroner.
Perioder, grupper og elektronstruktur
Grundstoffernes placering i perioder og grupper afspejler, hvordan elektronerne er fordelt i atomets skaller og underniveauer. Elementernes kemiske opførsel bestemmes især af antallet af valenselektroner (elektroner i yderste skal). Elementer i samme gruppe har ofte samme antal valenselektroner og dermed lignende kemiske egenskaber. De forskellige blokke i tabellen (s-, p-, d- og f-blokkene) svarer til hvilke underniveauer der fyldes af elektroner.
Hovedkategorier og specielle grupper
- Gruppe 1: Alkalimetaller – meget reaktive metaller, især med vand (fx natrium, kalium).
- Gruppe 2: Jordalkalimetaller – mindre reaktive end gruppe 1, svære at finde i fri form i naturen.
- Gruppe 17: Halogener – meget reaktive ikke-metaller (fx fluor, klor).
- Gruppe 18: Ædelgasser – næsten inert, fås som monoatomiske gasser under normale forhold.
- Overgangsmetaller (grupperne 3–12): Har ofte flere oxidationstilstande og bruges bredt i konstruktion og katalyse.
- Indre overgangsmetaller: Lanthanider og actinider (ofte placeret i to rækker under hovedtabellen) – inkluderer sjældne jordarter og radioaktive elementer.
Periodiske tendenser
Der er flere velkendte mønstre (tendenser) i det periodiske system, som hjælper med at forudsige egenskaber:
- Atomradius: Stiger ned gennem en gruppe (flere skaller) og falder mod højre i en periode (større effektiv kerne-ladning trækker elektroner tættere på).
- Ioniseringsenergi: Energi krævet for at fjerne en elektron; falder ned ad en gruppe og stiger mod højre i en periode.
- Elektronegativitet: Atomets evne til at tiltrække elektroner i en binding; stiger generelt mod højre og opad i tabellen.
- Metallisk karakter: Øger nedad og mod venstre; metaller afgiver lettere elektroner og danner positive ioner.
Antal kendte grundstoffer og syntetiske elementer
I dag er der bekræftet 118 grundstoffer (indtil element 118, og nogle af de tungeste er syntetiske og kun fremstillet i laboratorier). Nogle af disse tunge elementer er højst ustabile og findes kun i meget små mængder i kort tid.
Historie og moderne standarder
Selvom Dmitry Mendeleyev er berømt for at have udarbejdet en tidlig og praktisk tabel, blev andre forskeres opdagelser og senere atomfysiske teorier integreret i den moderne udgave. IUPAC bestemmer i dag officielle navne, atomnumre og gruppebetegnelser, og det arabiske gruppenummersystem (1–18) anvendes internationalt siden 1990.
Praktisk anvendelse
Det periodiske system er et centralt værktøj i kemi, materialeforskning, fysik og ingeniørvidenskab. Det hjælper med at forudsige reaktionsmønstre, udvælge materialer, forstå biologiske processer og designe nye stoffer og katalysatorer.
Yderligere bemærkninger
Tabellen udvikler sig stadig: nye syntetiske isotoper og elementer undersøges, og forståelsen af atomare egenskaber finjusteres med forbedrede eksperimentelle metoder og teoretiske modeller. Den periodiske lov — at egenskaberne gentager sig periodisk med atomnummer — holder fortsat som en af grundpillerne i moderne kemi.
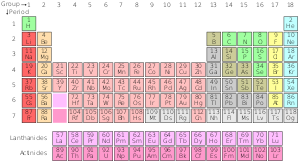
Standardvariationen af det periodiske system
Periodisk standardsystem
| Gruppe→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 12 | 13 | 14 | 15 | 16 | 17 | ||||
| 1 | 2 | |||||||||||||||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||||||||||
| 3 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||
| 4 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | ||
| 5 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | ||
| 6 | 55 | 56 | * Lanthanider | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | ||
| 7 | 87 Fr | 88 | ** Aktinider | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | ||
| 8 | 119 Uue | 120 Ubn | *** Superactinider | |||||||||||||||||
| * Lanthanidserien | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | |||||
| ** Actinide-serien | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | |||||
| *** Superactinide-serien | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129Ube | 130Utn | 131Utu | 132Utb | 133Utt | 134Utq | 135Utp | |||||
| *** Superactinide-serien | 136Uth | 137Uts | 138Uto | 139Ute | 140Uqn | 141Uqu | 142Uqb | 143Uqt | 144Uqq | 145Uqp | 146Uqh | 147Uqs | 148Uqo | 149Uqe | 150Upn | |||||
| *** Superactinide-serien | 151Upu | 152Upb | 153Upt | 154Upq | 155Upp | 156Uph | 157Ups | 158Upo | 159Upe | 160Uhn | 161Uhu | 162Uhb | 163Uht | 164Uhq | 165Uhp | |||||
| *** Superactinide-serien | 166Uhh | 167Uhs | 168Uho | 169Uhe | 170Usn | 171Usu | 172Usb | 173Ust | 174Usq | 175Usp | 176Ush | 177Uss | 178Uso | 179Brug | 180Uon | |||||
| *** Superactinide-serien | 181Uou | 182Uob | 183Uot | 184Uoq | 185Uop | 186Uoh | 187Uos | 188Uoo | 189Uoe | 190Uen | 191Ueu | 192Ueb | 193Uet | 194Ueq | 195Uep | |||||
| *** Superactinide-serien | 196Ueh | 197Ues | 198Ueo | 199Uee | 200Bnn | 201Bnu | 202Bnb | 203Bnt | 204Bnq | 205Bnp | 206Bnh | 207Bns | 208Bno | 209Bne | 210Bun | |||||
| *** Superactinide-serien | 211Buu | 212Bub | 213Men | 214Buq | 215Bup | 216Buh | 217Bus | 218Buo | 219Bue | 220 mia. | 221Bbu | 222Bbb | 223Bbt | 224Bbq | 225Bbp | |||||
Kemiske serier i det periodiske system
- Alkalimetaller
- Alkaliske jordarter
- Lanthanider
- Aktinider
- Superactinider
- Overgangsmetaller
- Dårlige metaller
- Ikke-metaller
- Halogener
Tilstand ved standardtemperatur og -tryk. Farven på tallet (atomnummeret) over grundstofsymbolet viser grundstoffets tilstand under normale forhold.
- de blå er gasser
- de grønne er væsker
- de sorte er solide
- De med faste grænser har stabile isotoper (grundstoffer)
- De med stiplede grænser har kun radioaktive naturligt forekommende isotoper
- De med stiplede grænser forekommer ikke naturligt (syntetiske grundstoffer)
- dem uden grænser er for radioaktive til at være blevet opdaget endnu.
Andre metoder til visning af de kemiske grundstoffer
Den version af det periodiske system, der er vist ovenfor, er den mest anvendte. Andre udbredte versioner er vist nedenfor:
· 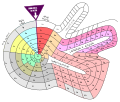
Theodor Benfey arrangerede grundstofferne i en spiral omkring brint. Atomvægten bestemmer elementets placering.
· 
Dmitry Ivanovich Mendeleyev brugte et blomsterarrangement; aktinider og lanthanider er vist som sløjfer ved siden af hovedgruppen.
· 
Timothy Stove opstillede grundstofferne efter kvantetal.
· ![]()
Betterman opstillede elementerne efter deres isoelektriske egenskaber, som kan omdannes til en polynomial form.
· 
Trekantet udgave, af Zmaczynski og Bayley
· 
Anbragt i en pyramide.
Mindre anvendte versioner
- Standardtabellen indeholder de grundlæggende oplysninger. Det er vist ovenfor
- En lodret tabel for at forbedre læsbarheden i webbrowsere
- Den store tabel indeholder de grundlæggende oplysninger samt de fuldstændige elementnavne
- Den store tabel indeholder de grundlæggende oplysninger samt alle grundstoffernes navne og atommasser
- Elektronkonfigurationer
- Metaller og ikke-metaller
- Liste over grundstoffer: indeholder navn, symbol, atomnummer, atommasse, gruppe og periode; kan sorteres efter en af disse
- Liste over elementer efter symbol
- Liste over grundstoffer efter kogepunkt
- Liste over grundstoffer efter smeltepunkt
- Liste over grundstoffer efter densitet
Relaterede sider
- Periodesystem gruppe
- Periode i det periodiske system
- Udvidet periodisk system
Spørgsmål og svar
Spørgsmål: Hvad er det periodiske system?
A: Det periodiske system er et skema, der opstiller alle kendte kemiske grundstoffer i rækkefølge efter deres atomnummer, begyndende med hydrogen som nummer et. Elementer med lignende egenskaber er ofte placeret i nærheden af hinanden.
Spørgsmål: Hvor mange perioder og grupper er der i det almindelige periodiske system?
Svar: Der er 8 perioder og 18 grupper i det periodiske system.
Spørgsmål: Hvad har grundstofferne i en periode til fælles?
Svar: Elementer i en periode har på hinanden følgende atomnumre.
Spørgsmål: Hvad har grundstoffer i en gruppe til fælles?
Svar: Elementer i en gruppe har elektroner, der er anbragt på samme måde i henhold til antallet af valenselektroner, hvilket giver dem ensartede kemiske egenskaber.
Spørgsmål: Hvem opfandt det periodiske system?
Svar: Den russiske kemiker Dmitry Ivanovich Mendeleyev opfandt det periodiske system (1834-1907).
Spørgsmål: Hvad er de tre hovedgrupper i det periodiske system?
Svar: De tre hovedgrupper i det periodiske system er metaller, metalloider og ikke-metaller.
Spørgsmål: Hvordan kan man observere mønstre og relationer mellem grundstoffer ved hjælp af det periodiske system?
A: Mønstre og relationer mellem grundstoffer kan observeres ved at se på, hvor de optræder i det periodiske system; f.eks. har grundstoffer nederst til venstre i det periodiske system en tendens til at være mere metalliske end grundstoffer øverst til højre.
Søge