Aldehyd – definition, struktur, egenskaber og anvendelser
Aldehyd – klar definition, molekylstruktur, kemiske egenskaber og praktiske anvendelser. Lær om formylgruppen, forskelle til ketoner og brug i duftstoffer.
En aldehyd (/ˈældɪhaɪd/) er en organisk forbindelse, som indeholder en formylgruppe. En formylgruppe har generel struktur R-CHO: et kulstof (carbon) dobbeltbundet til oxygen. Carbonet er også bundet til et hydrogen og en R-gruppe — hvor R repræsenterer resten af molekylet (en alkyl-, aryl- eller anden sidekæde). Gruppen uden sidekæden kaldes aldehydgruppen eller formylgruppen. Aldehyder adskiller sig fra ketoner, fordi formylgruppen sidder i enden af molekylet i en aldehyd, mens ketoners carbonylgruppe sidder internt i kæden. Aldehyder er almindelige i organisk kemi og optræder både som naturlige bestanddele i planter og fødevarer samt som vigtige industrielle mellemprodukter. Mange duftstoffer og smagsstoffer er aldehyder.
Struktur og elektroniske egenskaber
Aldehydgruppen indeholder en carbonylgruppe (C=O). Den elektronegative oxygen trækker elektronpar væk fra carbonet, hvilket gør carbonylcarbonet elektrofilisk (modtageligt for nukleofile angreb). Afledt heraf er følgende karakteristika typiske:
- Polaritet: C=O- bindingen er polar, hvilket øger aldehyders opløselighed i polære opløsningsmidler sammenlignet med tilsvarende kulbrinter.
- Reaktivitet: Carbonylcarbonet er et mål for nukleofile reaktioner (f.eks. additioner) og kan let oksideres eller reduceres.
- Stabilitet: Simple aldehyder (fx formaldehyd) er meget reaktive; sterisk beskyttede eller aromatiske aldehyder (fx benzaldehyd) er relativt mere stabile.
Egenskaber og typiske reaktioner
- Nukleofil addition: Aldehyder gennemgår addition af nukleofiler (f.eks. reduktion til primære alkoholer ved hydrogenering eller reaktion med hydride-donorer).
- Oxidation: Primære alkoholer kan oxideres til aldehyder, og aldehyder kan videreoxideres til carboxylsyrer ved mange oxiderende reagenser.
- Kondensationsreaktioner: Aldol-kondensationer hvor to aldehyder (eller en aldehyd og en keton) kobles sammen sker ofte under basiske eller sure betingelser.
- Bildning af iminer (Schiff-baser): Reaktion med aminer danner iminer, som er vigtige i biokemi og syntese.
- Dannelse af acetaler/hemiacetaler: Under sure forhold reagerer aldehyder med alkoholer til (hemi)acetaler, et centralt princip i beskyttelse af carbonylgrupper.
- Analytiske test: Tollens' reagens (sølvspejl) og Schiff's reagens anvendes til at påvise visse aldehyder (særligt alifatiske, reducerende aldehyder).
Nomenklatur og eksempler
I IUPAC-navngivning får aldehyder typisk endelsen -al. Eksempler:
- Formaldehyd (IUPAC: methanal) — den simpleste aldehyd, H-CHO.
- Acetaldehyd (IUPAC: ethanal) — CH3-CHO, velkendt i biologisk oxidation af ethanol.
- Benzaldehyd — en aromatisk aldehyd (C6H5-CHO) med karakteristisk mandelagtig lugt.
Fremstilling
- Oxidation af primære alkoholer: Kontrolleret oxidation af en primær alkohol giver først aldehyd (f.eks. ethanol → acetaldehyd).
- Hydroformylering: Addition af CO og H2 til alken giver aldehyder (vigtig industriel rute for fremstilling af lange kæde-aldehyder).
- Rosenmund-reduktion: Reduktion af acylchlorider til aldehyder under særlige forhold.
- Andre syntetiske metoder: F.eks. Gattermann–Koch-formylering for aromatiske aldehyder, eller via organometalliske mellemprodukter.
Anvendelser
Aldehyder har mange anvendelser i industri, landbrug og husholdning:
- Produktion af harpiks og polymerer — formaldehyd anvendes i fremstilling af melamin-, phenol- og urea-formaldehydharpikser.
- Kemiindustri — aldehyder er vigtige mellemprodukter ved fremstilling af dufte, smagsstoffer og farmaceutiske forbindelser.
- Konserveringsmidler og desinfektionsmidler — formaldehyd anvendes i nogle konserverings- og desinfektionsprodukter (med restriktioner pga. toksicitet).
- Fremstilling af farvestoffer og agro-kemikalier.
- Naturlige dufte og aromaer — mange naturligt forekommende aldehyder bidrager til frugt- og blomsterdufte.
Sikkerhed og miljø
Mange aldehyder er kemisk reaktive og kan være sundhedsskadelige. Bemærk:
- Formaldehyd er irriterende for øjne og luftveje og er klassificeret som kræftfremkaldende ved langvarig eksponering.
- Andre lave aldehyder (fx acetaldehyd) virker toksisk og kan give irritation og systemiske effekter.
- Håndtering kræver passende arbejdspladsventilation, personlige værnemidler og korrekt opbevaring for at undgå udsættelse.
- Mange aldehyder kan nedbrydes i miljøet, men nogle er persistente eller giftige for organismer og bør håndteres efter gældende regler.
Opsummering
Aldehyder er en vigtig klasse af organiske forbindelser kendetegnet ved formylgruppen R-CHO. Deres polaritet og reaktivitet gør dem centrale i både naturlige processer og i industriel kemi. Samtidig kræver deres anvendelse respekt for sikkerheds- og miljøhensyn.
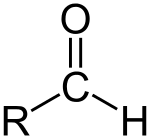
En aldehyd.
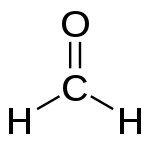
Formaldehyd, som er den enkleste aldehyd
Struktur og binding
Aldehyder har et kulstof dobbeltbundet til et oxygen. På grund af dette er de svagt polære. Dette medfører, at aldehyder har en række egenskaber. En af de vigtigste af disse er opløseligheden i vand.
Nomenklatur
IUPAC-navne for aldehyder
De almindelige navne for aldehyder er ikke altid de officielle navne. IUPAC-navnene er dog nyttige. IUPAC anbefaler følgende nomenklatur for aldehyder:
- Aldehyder uden kulstofringe navngives på grundlag af den længste kulstofkæde, der indeholder aldehydet. HCHO er således navngivet på grundlag af metan, og CH3CH CH 2CH 2CH CHO er navngivet på grundlag af butan. Navnet dannes ved at ændre endelsen -e i den oprindelige alkan til -al. HCHO benævnes methanal. CH 3CH CH 2CH 2CH CHO benævnes butanal.
- Hvis en -CHO-gruppe er knyttet til en ring, tilføjes -carbaldehyd til sidst i navnet. Derfor er C 6H11 CHO kendt som cyclohexanecarbaldehyd. Hvis der er andre navne, der skal tilføjes til slutningen af ordet, fordi der er andre funktionelle grupper til stede, tilføjes formyl- til begyndelsen af ordet. Methanoyl- tilføjes nogle gange i stedet, men formyl- er bedre.
Etymologi
Ordet aldehyd stammer fra latin. Det blev forkortet fra alcohol dehydrogenatus (dehydrogeneret alkohol). Ordet aldehyd blev skabt af Justus von Liebig. Tidligere blev aldehyder undertiden opkaldt efter de tilsvarende alkoholer, f.eks. vinaldehyd for acetaldehyd. (Vinous er fra det latinske ord for vin, som er den traditionelle kilde til ethanol).
Udtrykket formylgruppe stammer fra det latinske eller italienske ord formica, der betyder myre.
Myresyre
Fysiske egenskaber og karakterisering
Aldehyder har mange forskellige egenskaber. Disse egenskaber ændrer sig meget, hvis resten af molekylet ændres. Mindre aldehyder er mere opløselige i vand. Formaldehyd og acetaldehyd er helt opløselige i vand. Mange aldehyder har stærke lugte. Aldehyder nedbrydes i luft.
To af de vigtigste aldehyder, formaldehyd og acetaldehyd, har en tendens til at danne lange kæder. Dette kaldes polymerisering.
Naturligt forekommende aldehyder
Mange aldehyder findes i æteriske olier og er årsagen til deres duft. Cinnamaldehyd, koriander og vanillin får alle deres lugt fra aldehyder.
Almindelige reaktioner
Aldehyder er meget reaktive og deltager i mange reaktioner." I industrien bruges aldehyder til at fremstille blødgøringsmidler, polyoler og alkoholer. I biologien anvendes aldehyder til at erstatte aminogrupper og danne sukkerstoffer.
Dialdehyder
En dialdehyd er et molekyle med to aldehyder. Navnene på dialdehyder har endelsen -dial eller -dialdehyd. Nogle dialdehyder er opkaldt efter den syre, som de ligner. Et eksempel er butanedial, som også kaldes succinaldehyd (fra bikseddikesyre).
Eksempler på aldehyder
- Methanal (formaldehyd)
- Ethanal (acetaldehyd)
- Propanal (propionaldehyd)
- Butanal (butyraldehyd)
- Benzaldehyd
- Cinnamaldehyd
- Tolualdehyd
- Furfural
- Retinaldehyd
Dialdehyder
- Glyoxal
- Malondialdehyd
- Succindialdehyd
- Glutaraldehyd
- Phthalaldehyd
Bruger
Af alle aldehyder er formaldehyd den mest producerede. Der fremstilles ca. 6 millioner tons om året. Det bruges hovedsagelig til at fremstille harpikser, når det blandes med urinstof, melamin og phenol. Bakelit fremstilles på denne måde. En anden aldehyd, der ofte fremstilles, er butyraldehyd. Der fremstilles 2,5 millioner tons om året. Der blev engang fremstillet meget acetaldehyd, men der fremstilles meget mindre i dag. Det skyldes, at de kemikalier, der tidligere blev fremstillet af acetaldehyd, nu fremstilles på andre måder.
Relaterede sider
Spørgsmål og svar
Spørgsmål: Hvad er en aldehyd?
A: En aldehyd er en organisk forbindelse, der indeholder en formylgruppe.
Spørgsmål: Hvad er en formylgruppe?
Svar: En formylgruppe er en del af et molekyle med strukturen R-CHO, som består af et kulstof, der er dobbeltbundet til oxygen og også bundet til hydrogen og en R-gruppe.
Spørgsmål: Hvad er en sidekæde i et molekyle?
Svar: En sidekæde er resten af molekylet uden den funktionelle gruppe.
Sp: Hvad er den funktionelle gruppe i en aldehyd?
Svar: Den funktionelle gruppe i en aldehyd er aldehydgruppen eller formylgruppen.
Spørgsmål: Hvordan adskiller aldehyder sig fra ketoner?
Svar: Formylgruppen i aldehyder er placeret i enden af molekylet, mens den i ketoner er placeret i midten.
Spørgsmål: Hvilken betydning har aldehyder i organisk kemi?
Svar: Aldehyder er almindelige i organisk kemi og anvendes i mange reaktioner som reaktanter eller mellemprodukter.
Spørgsmål: Hvad er nogle almindelige anvendelser af aldehyder?
A: Mange parfumer, som f.eks. Chanel No. 5, består af aldehyder. De kan bruges som konserveringsmidler i fødevarer. De anvendes som mellemprodukter i produktionen af lægemidler, farvestoffer og andre kemikalier.
Søge