Elektron – definition, egenskaber, opdagelse og rolle i atomfysik
Elektron – forstå definition, egenskaber, opdagelse og atomfysikkens rolle: negativ ladning, masse, bevægelse, central for elektricitet, kemiske bindinger og partikelinteraktioner.
En elektron er en meget lille del af stof. Dens symbol er e−, og den blev først påvist af J. J. Thomson i 1897 ved eksperimenter med katodestråler. Elektronen betragtes som en subatomar partikel og regnes i dag for en elementarpartikel, fordi den ikke kan opdeles i mindre bestanddele i de kendte eksperimenter.
Grundlæggende egenskaber
- Elektrisk ladning: Elektronen har en negativ elektrisk ladning med absolut værdi 1,602176634×10−19 coulomb (denne værdi er grundlaget for SI-enheden coulomb).
- Masse: Elektroner har meget lille masse: cirka 9,10938356×10−31 kg. På grund af den lave masse kræver det relativt lidt energi at give dem høj hastighed.
- Spin og kvantetype: Elektronen er en fermion med spinnet 1/2. Den indgår i Standardmodellen som en type lepton og har en antistofpartner, positronen (e+).
- Relativistiske hastigheder: Elektroner kan opnå hastigheder tæt på lysets hastighed i stærke elektriske felter eller i partikelacceleratorer; eksempelvis ses højehastighedselektroner som beta-partikler ved nogle typer radioaktivt henfald.
- Felt og magnetiske egenskaber: En elektron skaber et elektrisk felt og har et magnetisk moment. Dets bevægelse og spin medfører de magnetiske effekter, der udnyttes i mange teknologier.
Opdagelse og målinger
J. J. Thomsons arbejde med katodestråler i 1897 viste, at strålerne bestod af negativt ladede partikler (elektroner). Senere eksperimenter, bl.a. Millikans olie-dråbe-eksperiment (omkring 1909), kvantificerede elektrons ladning. Målinger af masse, ladning og magnetiske egenskaber er siden blevet finjusteret med præcise eksperimenter.
Elektronens rolle i atomet og kemi
Hvert atom består af elektroner, der bevæger sig omkring atomets kerne. Elektroner kan også være helt adskilt fra et atom — frie elektroner findes i ledere, i stråling og i plasmaniveauer. I moderne kvantmekanik beskrives elektronernes tilstande af bølgefunktioner (elektronorbitaler) frem for klassiske baner.
Elektronskaller og -orbitaler (elektronskaller) bestemmer atomers kemiske egenskaber og placeringen i det periodiske system (grundstoffer) ved et givet atomnummer. Pauli-princippet og elektronernes arrangement i orbitaler forklarer kemisk binding (kovalent, ionisk, metallisk) og stoffers reaktivitet.
Interaktioner og partikelfysik
Elektroner deltager i flere fundamentale vekselvirkninger: gravitationelle, elektromagnetiske og svage vekselvirkninger. Af disse er den elektromagnetiske kraft normalt dominerende i kemiske og dagligdags situationer. Fordi elektroner har samme elektriske ladning frastøder (repellerer) de hinanden, mens de tiltrækkes af protoner med modsat ladning. Disse kræfter forklares af det elektriske felt rundt om en elektron.
I nukleare processer som beta-minus henfald udsendes ofte en elektron (sammen med en antineutrino) fra en neutron, hvilket er en manifestation af de svage vekselvirkninger. Elektroners bølge-partikel-dualitet viser sig i fænomener som elektrondiffraction og de kvantemekaniske energiniveauer i atomer.
Elektricitet, ledning og anvendelser
Den elektricitet, som driver fjernsyn, motorer, mobiltelefoner og mange andre apparater, er i metalledere i praksis mange elektroner, der bevæger sig gennem ledere. Bemærk at den konventionelle strømretning historisk er defineret som bevægelsen af positiv ladning og derfor er modsat af den faktiske gennemsnitsretning for elektroner i en metalleder.
Elektroner udnyttes i utallige teknologier: elektronmikroskoper (hvor elektronstråler giver meget høj opløsning), katodestrålerør (tidligere i fjernsyn og oscilloskoper), røntgen- og partikelacceleratorer samt i moderne elektronik og halvlederkomponenter. Superledende strøm, halvlederfysik og transistoroperation er alle knyttet til elektroners bevægelse og kvantetilstande.
Målemetoder og vigtige konstante størrelser
Fysiske konstante værdier for elektronen er målt med stor nøjagtighed: elektrisk ladning |e| = 1,602176634×10−19 C (defineret værdi i SI), og hvilemassen m_e ≈ 9,10938356×10−31 kg. Andre relevante størrelser er elektronens klassiske radius og Compton-bølgelængde, som bruges i teoretiske beskrivelser af felt- og kvanteeffekter.
Sammenfattende er elektronen en grundlæggende negativt ladet elementarpartikel med stor betydning i atomfysik, kemi, teknologi og moderne partikel- og feltteori. Dens lille masse, kvantemekaniske natur og elektriske egenskaber gør den central i næsten alle fysiske processer, der involverer stof og elektricitet.
Beskrivelse
Elektroner har den mindste elektriske ladning. Denne elektriske ladning er lig med protonens ladning, men har modsat fortegn. Derfor tiltrækkes elektronerne af protonerne i atomkerner. Denne tiltrækning gør, at elektroner i nærheden af en kerne danner et atom. En elektron har en masse på ca. 1/1836 gange en proton.
En måde at tænke på elektronernes placering i et atom på er at forestille sig, at de kredser i faste afstande fra kernen. På denne måde findes elektronerne i et atom i et antal elektronskaller, der omgiver den centrale kerne. Hver elektronskal får et nummer 1, 2, 3 osv., startende fra den, der er tættest på kernen (den inderste skal). Hver skal kan indeholde op til et bestemt maksimalt antal elektroner. Fordelingen af elektroner i de forskellige skaller kaldes elektronisk arrangement (eller elektronisk form eller form). Elektronarrangementet kan vises ved hjælp af nummerering eller et elektrondiagram. (En anden måde at tænke på elektronernes placering på er at bruge kvantemekanikken til at beregne deres atomorbitaler).
Elektronen er en af en type subatomare partikler, der kaldes leptoner. Elektronen har en negativ elektrisk ladning. Elektronen har en anden egenskab, der kaldes spin. Dens spinværdi er 1/2, hvilket gør den til en fermion.
Mens de fleste elektroner findes i atomer, bevæger andre sig uafhængigt af hinanden i stof eller sammen som katodestråler i et vakuum. I nogle superledere bevæger elektronerne sig parvis. Når elektroner flyder, kaldes denne strøm for elektricitet eller en elektrisk strøm.
Et objekt kan beskrives som "negativt ladet", hvis der er flere elektroner end protoner i et objekt, eller "positivt ladet", hvis der er flere protoner end elektroner. Elektroner kan bevæge sig fra et objekt til et andet, når de berøres. De kan tiltrækkes til et andet objekt med modsat ladning eller frastødes, når de begge har samme ladning. Når et objekt er "jordet", går elektroner fra det ladede objekt ned i jorden, hvilket gør objektet neutralt. Det er det, som lynafledere (lynledere) gør.
Kemiske reaktioner
Elektroner i deres skaller omkring et atom er grundlaget for kemiske reaktioner. Komplette ydre skaller med flest mulige elektroner er mindre reaktive. Ydre skaller med færre end det maksimale antal elektroner er reaktive. Antallet af elektroner i atomerne er det grundlæggende grundlag for det kemiske periodiske system.
Måling
Elektrisk ladning kan måles direkte med et apparat, der kaldes et elektrometer. Elektrisk strøm kan måles direkte med et galvanometer. Den måling, der foretages af et galvanometer, er forskellig fra den måling, der foretages af et elektrometer. I dag er laboratorieinstrumenter i stand til at indeholde og observere individuelle elektroner.
"Se" en elektron
Under laboratorieforhold kan de enkelte elektroners interaktioner observeres ved hjælp af partikeldetektorer, som gør det muligt at måle specifikke egenskaber såsom energi, spin og ladning. I et tilfælde blev en Penning-fælde brugt til at holde en enkelt elektron i 10 måneder. Elektronens magnetiske moment blev målt med en præcision på 11 cifre, hvilket i 1980 var en større nøjagtighed end for nogen anden fysisk konstant.
De første videobilleder af en elektrons energifordeling blev optaget af et hold fra Lunds Universitet i Sverige i februar 2008. Forskerne brugte ekstremt korte lysglimt, såkaldte attosekunder, som gjorde det muligt for første gang at observere en elektrons bevægelse. Elektronernes fordeling i faste materialer kan også visualiseres.
Antipartikel
Elektronens antipartikel kaldes en positron. Den er identisk med elektronen, men bærer elektriske og andre ladninger med modsat fortegn. Når en elektron kolliderer med en positron, kan de spredes fra hinanden eller blive fuldstændig tilintetgjort og producere et par (eller flere) gammastrålefotoner.
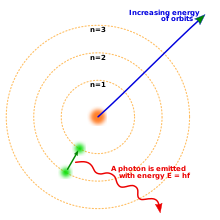
Niels Bohrs model af atomet. Tre elektronskaller omkring en kerne, hvor en elektron bevæger sig fra det andet til det første niveau og frigiver en foton.
Historien om dens opdagelse
Elektronernes virkninger var kendt længe før de kunne forklares. De gamle grækere vidste, at når man gned rav mod pels, blev små genstande tiltrukket. Nu ved vi, at gnidningen fjerner elektroner, og det giver rav en elektrisk ladning til rav. Mange fysikere arbejdede med elektronen. J.J. Thomson beviste i 1897, at den eksisterede, men en anden mand gav den navnet "elektron".
Elektronsky-modellen
Modellen ser elektroner som værende i ubestemte positioner i en diffus sky omkring atomets kerne.
Usikkerhedsprincippet betyder, at en person ikke kan kende en elektrons position og energiniveau på samme tid. Disse potentielle tilstande danner en sky omkring atomet. Elektronernes potentielle tilstande i et enkelt atom danner en enkelt, ensartet sky.
Relaterede sider
- Positron
- Proton
- Neutron
Spørgsmål og svar
Spørgsmål: Hvad er en elektron?
A: En elektron er et meget lille stykke stof, og det er en subatomar partikel. Den kan ikke opdeles i noget mindre og har en negativ elektrisk ladning.
Spørgsmål: Hvem opdagede elektronen?
Svar: Elektronen blev opdaget af J.J. Thomson i 1897.
Spørgsmål: Hvor stor masse har en elektron?
Svar: Elektroner har meget lidt masse eller vægt, så der skal meget lidt energi til for at flytte dem hurtigt.
Spørgsmål: Hvilken type vekselvirkninger deltager elektroner i?
Svar: Elektroner deltager i gravitationelle, elektromagnetiske og svage vekselvirkninger. Den elektromagnetiske kraft er stærkest i almindelige situationer.
Spørgsmål: Hvordan vekselvirker elektroner med hinanden?
A: Elektroner frastøder hinanden, fordi de har den samme elektriske ladning, men de tiltrækkes af protoner, fordi de har modsatte elektriske ladninger.
Spørgsmål: Hvad driver fjernsyn, motorer, mobiltelefoner og mange andre ting?
A: Den elektricitet, der driver disse apparater, er faktisk mange elektroner, der bevæger sig gennem ledninger eller andre ledere.
Søge