Molekyler: Hvad er et molekyle? Struktur, bindinger og tilstande
Lær hvad et molekyle er: struktur, bindinger og tilstande (gas, væske, fast, plasma) samt molekylformler som C6H12O6 — klar, kort og letforståelig guide.
Et molekyle er den mindste enhed af et kemisk stof, der kan eksistere som dette stof med de samme kemiske egenskaber. Hvis et molekyle blev delt i mindre stykker, ville de nye stykker tilhøre et andet stof eller være reaktive fragmenter.
Hvordan er molekyler opbygget?
Molekyler består af atomer, der sidder sammen i en bestemt form ved hjælp af kemiske bindinger. Atomernes evne til at danne et bestemt antal forbindelser beskrives ofte med valens (eller oxidationstal). For eksempel:
- Ilttomer danner som regel to bindinger.
- Kulstof danner typisk fire bindinger og kan derfor bygge komplekse kæder og ringe.
- Nitrogen danner normalt tre bindinger.
Denne begrænsning i antallet af bindinger og i geometriske muligheder forklarer, hvorfor ikke alle kombinationer af atomer kan give stabile molekyler.
Typer af kemiske bindinger
Molekyler holdes sammen af forskellige typer bindinger og intermolekylære kræfter:
- Kovalente bindinger — delt elektronpar mellem atomer; kan være enkelt-, dobbelt- eller tripelbindinger. De bestemmer ofte molekylets skelet og geometri.
- Ioniske bindinger — tiltrækning mellem positive og negative ioner; almindelig i salte (ofte mindre “molekylære” i snæver forstand, men danner ioniske enheder).
- Metalbindinger — delokaliserede elektroner i metaller; giver materialer som ledningsevne og duktilitet.
- Koordinative (dative) bindinger — et atom stiller begge elektroner til et delt par.
- Intermolekylære kræfter — hydrogenbindinger, dipol-dipol-interaktioner og van der Waals-kræfter; disse bestemmer egenskaber som kogepunkt, smeltepunkt og opløselighed.
Form og geometri
Elektronpar og bindinger omkring et centralt atom bestemmer molekylets form. VSEPR-teorien (valence shell electron pair repulsion) forudsiger former som lineær, trigonal planar, tetraedrisk, bøjelig (vinkel), trigonal bipyramidal mv. Molekylgeometri påvirker egenskaber som polaritet, reaktivitet og biologisk aktivitet.
Nogle molekyler har delokaliserede elektroner og resonans, hvor den reelle elektronfordeling er et gennemsnit af flere strukturer — det ses fx i benzenringen.
Molekyler i forskellige stoftilstande
I den kinetiske teori omtales molekyle ofte om enhver gaspartikel, uanset om den er sammensat af et atom eller flere; derfor betragtes også ædelgasatomer som monoatomare “molekyler”.
I praksis optræder molekyler forskelligt afhængigt af tilstanden:
- I gasser som luft bevæger molekylerne sig frit og kolliderer elastisk; interaktionerne mellem molekyler er ofte svage sammenlignet med bindinger inde i molekylet.
- I væsker som vand er molekyler mere tæt pakkede og påvirker hinanden via intermolekylære kræfter, men de kan stadig bevæge sig og glide forbi hinanden.
- I faste stoffer som sukker er molekylerne i faste positioner i et netværk eller krystal, og kan primært vibrere omkring deres ligevægtspositioner.
- I plasma, den fjerde stoftilstand, er atomerne ofte ioniseret (elektroner revet løs) og kan ikke længere danne stabile neutrale molekyler på samme måde.
Molekylformel, strukturformel og masse
En molekylformel angiver antallet af hvert atom i et molekyle. For eksempel er molekylformlen for glukose C6H12O6, hvilket betyder seks kulstof-, tolv brint- og seks oxygenatomer i ét molekyle glukose. Ud over molekylformlen findes:
- Empirisk formel — simpel forholdsangivelse mellem grundstoffer (eks. CH2O for glukoses empiriske formel).
- Strukturformel — viser, hvordan atomer er forbundet og molekylets form (kan inkludere stereokemi).
Molekylmasse (molar masse) beregnes som summen af atommasserne og angives ofte i g/mol. Til beregninger af stofmængde anvendes mol, hvor 1 mol = 6,022×10^23 partikler (Avogadros tal).
Særlige typer molekyler og begreber
- Monoatomare “molekyler” — noble gasser som He og Ne er enkeltatomære partikler, men i gaskinetisk sammenhæng tælles de som molekyler/partikler.
- Diatomare molekyler — nogle grundstoffer forekommer naturligt som to-atomers molekyler, f.eks. H2, O2, N2 og halogener.
- Isomerer — forbindelser med samme molekylformel, men forskellig struktur (fx glukose vs. fruktose eller cis/trans-isomerer).
- Polære vs. upolære molekyler — afhænger af forskelle i elektronegativitet og molekylgeometri; polaritet påvirker opløselighed og intermolekylære kræfter.
Hvorfor er forståelsen af molekyler vigtig?
Kendskab til molekylers opbygning og egenskaber ligger til grund for kemi, biokemi, materialeforskning, lægemiddeludvikling og miljøvidenskab. Molekylære interaktioner styrer reaktioner, stoftransport, katalyse og meget mere — fra simple reaktioner i laboratoriet til komplekse biologiske processer i levende organismer.
Hvis du vil, kan jeg uddybe et afsnit (f.eks. bindingsenergi, VSEPR-modellen, beregning af molarmasse eller eksempler på isomerer) eller lave simple tegninger/ASCII-illustrationer af molekylstrukturer.
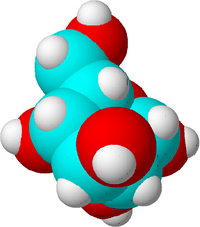
Dette er et sukkermolekyle. Kulstofatomerne er lavet blå, iltatomerne er lavet røde og hydrogenatomerne er lavet hvide for at vise forskellen. I virkeligheden har atomerne ikke nogen farve.
Bindning
For at et molekyle kan eksistere, skal atomerne holde sammen. Det sker, når to atomer deler elektroner. I stedet for kun at kredse om ét atom kredser elektronen nu om to. Dette kaldes en kovalent binding. Nogle gange deles mere end én elektron. Jo flere elektroner der deles, jo stærkere bliver bindingen, og jo stærkere holder atomerne sammen.
Bånd kan også brydes. Da de fleste bindinger kræver energi for at blive dannet, afgiver de også energi, når de brydes. Men før de fleste bindinger brydes, skal molekylet opvarmes. Så begynder atomerne at bevæge sig, og når de bevæger sig for meget, knækker bindingen. Molekyler, der kræver mindre energi at bryde, end de afgiver, når de er brudt, kaldes brændstoffer. Et stearinlys vil f.eks. bare sidde der, og der sker ikke noget. Men når du bruger en tændstik til at tænde det, vil det brænde i lang tid. Tændstikken tilfører energi til at bryde de første bindinger, som frigiver nok energi til at bryde bindingerne under dem, indtil stearinlyset er brændt ned.
Der findes også ioniske bindinger.
Spørgsmål og svar
Spørgsmål: Hvad er et molekyle?
A: Et molekyle er den mindste mængde af et kemisk stof, der kan eksistere. Det består af atomer, der sidder fast sammen i en bestemt form eller form.
Spørgsmål: Hvor mange bindinger har oxygen-, kulstof- og nitrogenatomer?
Svar: Oxygenatomer har altid to bindinger med andre atomer, kulstofatomer har altid fire bindinger med andre atomer, og nitrogenatomer har altid tre bindinger med andre atomer.
Spørgsmål: Hvad siger den kinetiske teori om gasser om molekyler?
Svar: Ifølge den kinetiske teori om gasser anvendes udtrykket molekyle ofte om enhver gaspartikel uanset dens sammensætning. Det betyder, at ædelgasatomer betragtes som molekyler, da de i virkeligheden er monoatomare molekyler.
Spørgsmål: Hvordan opfører molekyler sig i forskellige tilstande?
Svar: I gasser som luft flyver molekylerne bare rundt. I væsker som f.eks. vand sidder molekylerne fast sammen, men de kan stadig bevæge sig. I faste stoffer som sukker kan molekylerne kun vibrere. I plasma (den fjerde stoftilstand) er atomerne ioniseret og kan ikke danne molekyler.
Spørgsmål: Hvad er en molekylformel?
Svar: En molekylformel bruges til at skrive antallet af alle atomerne i et molekyle ned. F.eks. angiver C6H12O6 et molekyle glukose, som består af seks kulstofatomer, tolv hydrogenatomer og seks oxygenatomer.
Søge