Kvantemekanik: Hvad er kvantefysik? Enkel definition og grundprincipper
Kvantemekanik: Enkel og grundig guide til kvantefysik — forstå kvantebegreber, bølge‑partikeldualiteter og grundprincipper på letforståeligt dansk.
Kvantemekanikken forklarer, hvordan universet fungerer på de mindste skalaer — mindre end atomerne. Den kaldes også kvantefysik eller kvanteteori. Ordet Mekanik dækker den del af fysikken, der beskriver, hvordan ting bevæger sig, mens kvante kommer af det latinske ord for "hvor meget" og refererer til, at energi og andre størrelser findes i diskrete enheder eller kvanta. Et kvantum er den mindste mulige mængde af fx energi, og kvantemekanikken beskriver, hvordan disse kvanta opfører sig og interagerer.
Tidligere blev stof anset for at være opbygget af udelelige atomer, men moderne forskning viser, at atomer består af endnu mindre subatomare partikler som protoner, neutroner og elektroner. Kvantemekanikken beskriver adfærden af disse partikler og af elektromagnetiske bølger som fx lys.
Grundlæggende idéer
Der er nogle centrale træk ved kvantemekanik, som adskiller den fra klassisk mekanik:
- Bølge-partikel-dualitet: Partikler kan opføre sig som bølger, og bølger kan opføre sig som partikler — se Bølge-partikel-dualitet. Et eksempel er, at elektroner viser interferensmønstre i et dobbeltspalteeksperiment, ligesom lys gør.
- Kvantisering: Visse størrelser (energi, vinkelmoment osv.) kan kun antage bestemte diskrete værdier, ikke et kontinuum.
- Superposition: Et kvantesystem kan være i flere tilstande samtidig, indtil det måles. Før måling beskrives systemet af en kombination af mulige tilstande.
- Usikkerhedsrelationen: Der findes fundamentale grænser for, hvor præcist vi samtidig kan kende par af størrelser (fx position og momentum) — Jo mere præcis positionen er, desto mindre præcis er momentum.
- Statistisk/probabilistisk natur: Kvantemekanik giver sandsynligheder for udfald af målinger, ikke altid entydige deterministiske resultater som i klassisk fysik.
Hvordan vi beskriver kvantesystemer
Matematisk beskrives et kvantesystem af en bølgefunktion (eller en tilstandvektor) som indeholder alle informationer om systemets mulige tilstande. Den fleste beregninger bruger matematiske værktøjer fra lineær algebra og differentialligninger; central er Schrödinger-ligningen, som bestemmer, hvordan bølgefunktionen udvikler sig i tiden. Måling repræsenteres ofte ved operatorer, og resultatet af en måling bestemmes af forventningsværdier og sandsynlighedsfordelinger.
Måling og fortolkning
Måleprocessen i kvantemekanikken rejser filosofiske og praktiske spørgsmål: Hvornår og hvordan "kolliderer" en superposition til et konkret udfald? Dette er kendt som måleproblemet, og der findes flere fortolkninger (Københavnerfortolkningen, mange‑verdener, de Bohmske tolkninger m.fl.), som forsøger at forklare, hvad bølgefunktionen egentlig beskriver.
Entanglement og non‑lokalitet
Entanglement er et fænomen, hvor to eller flere partikler bliver bundet sammen, så målingen af den ene øjeblikkeligt påvirker den andens tilstand, uanset afstanden mellem dem. Dette førte til berømte diskussioner mellem Einstein og andre forskere og er i dag eksperimentelt bekræftet og udnyttet teknologisk (fx i kvantekryptering og kvantekommunikation).
Eksperimentelle beviser
Nogle klassiske eksperimenter og observationer, som førte til kvanteteoriens udvikling og bekræftelse, er:
- Fotoelektrisk effekt (forklaret af Planck og Einstein) — lys som kvanta (fotoner).
- Dobbeltspalteeksperimentet — demonstrerer bølge-partikel-dualitet og interferens.
- Spektrallinjer fra atomer — diskrete energiniveauer i atomer forklares kvantemekanisk.
Anvendelser
Kvantemekanik ligger til grund for mange moderne teknologier:
- Elektronik og halvlederteknologi (transistorer, dioder) — basis for computere og mobiltelefoner.
- Lasere og fotonik.
- Medicinsk billeddannelse som MRI.
- Kvanteteknologier: kvantekryptografi, kvantesensorer og fremvoksende kvantecomputere.
Kort historik og vigtige personer
Udviklingen af kvanteteorien begyndte omkring 1900 med Max Plancks forklaring af sortlegemestråling. Nøglepersoner inkluderer Niels Bohr, Albert Einstein, Erwin Schrödinger, Werner Heisenberg og Paul Dirac, som hver især bidrog med centrale ideer — fra atommodeller til den formelle matematik bag teorien.
Hvorfor virker kvantemekanik "mærkelig"?
Den føles mærkelig, fordi vores hverdagserfaring er baseret på makroskopiske objekter, hvor klassiske love gælder godt. På atomar og subatomar skala dominerer kvanteeffekter, som ikke har direkte analoge klassiske billeder — for eksempel at en partikel kan være i flere tilstande samtidig eller at resultatet af en individuel måling er statistisk. Alligevel er kvantemekanikken ekstremt præcis og succesfuld til at forudsige eksperimentelle resultater.
Samlet set giver kvantemekanikken et fundamentalt og praktisk rammeværk til at forstå naturen på de mindste skalaer og danner grundlaget for meget af moderne fysik og kemi. De underliggende matematiske beskrivelser kan være komplekse, men de afspejler naturens grundlæggende egenskaber og muliggør teknologier, der præger vores hverdag.
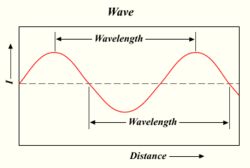
Bølgelængden af en lysbølge
Bølger og fotoner
Fotoner er partikler, der er punktstørrelse, mindre end atomer. Fotoner er som "pakker" eller pakker af energi. Lyskilder som stearinlys eller lasere producerer lys i bits, der kaldes fotoner.
Jo flere fotoner en lampe producerer, jo lysere er lyset. Lys er en form for energi, der opfører sig som bølger i vand eller radiobølger. Afstanden mellem toppen af en bølge og toppen af den næste bølge kaldes en "bølgelængde". Hver foton bærer en bestemt mængde, eller "kvantum", af energi afhængigt af bølgelængden.
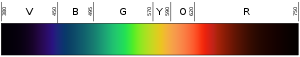
Et lys' farve afhænger af dets bølgelængde. Farven violet (den nederste eller inderste farve i regnbuen) har en bølgelængde på ca. 400 nm ("nanometer"), hvilket svarer til 0,00004 centimeter eller 0,000016 tommer. Fotoner med bølgelængder på 10-400 nm kaldes ultraviolet (eller UV-) lys. Sådant lys kan ikke ses af det menneskelige øje. I den anden ende af spektret er rødt lys omkring 700 nm. Infrarødt lys er ca. 700 nm til 300.000 nm. Menneskeøjne er heller ikke følsomme over for infrarødt lys.
Bølgelængder er ikke altid så små. Radiobølger har længere bølgelængder. Bølgelængderne for en FM-radio kan være flere meter lange (f.eks. udsender stationer, der sender på 99,5 FM, radioenergi med en bølgelængde på ca. 3 meter, hvilket svarer til ca. 10 fod). Hver foton har en vis mængde energi i forhold til sin bølgelængde. Jo kortere bølgelængde en foton har, jo større er dens energi. F.eks. har en ultraviolet foton mere energi end en infrarød foton.
Bølgelængde og frekvens (antallet af gange bølgen går op i sekundet) er omvendt proportionale, hvilket betyder, at en længere bølgelængde vil have en lavere frekvens og omvendt. Hvis lysets farve er infrarødt lys (lavere frekvens end rødt lys), kan hver foton opvarme det, den rammer, opvarme det, den rammer. Så hvis en stærk infrarød lampe (en varmelampe) rettes mod en person, vil denne person føle sig varm eller endog varm på grund af den energi, der er lagret i de mange fotoner. Overfladen af den infrarøde lampe kan endda blive varm nok til at brænde en person, der rører ved den. Mennesker kan ikke se infrarødt lys, men vi kan føle strålingen i form af varme. En person, der f.eks. går forbi en murstensbygning, der er blevet opvarmet af solen, vil føle varme fra bygningen uden at skulle røre ved den.
Kvantemekanikkens matematiske ligninger er abstrakte, hvilket betyder, at det er umuligt at kende en partikels nøjagtige fysiske egenskaber (f.eks. dens position eller impuls) med sikkerhed. I stedet giver en matematisk funktion kaldet bølgefunktionen oplysninger om den sandsynlighed, hvormed en partikel har en given egenskab. Bølgefunktionen kan f.eks. fortælle dig, hvor stor sandsynligheden er for, at en partikel kan findes et bestemt sted, men den kan ikke med sikkerhed fortælle dig, hvor den befinder sig. På grund af denne usikkerhed og andre faktorer kan man ikke bruge den klassiske mekanik (den fysik, der beskriver, hvordan store objekter bevæger sig) til at forudsige kvantepartiklers bevægelse.
Ultraviolet lys har en højere frekvens end violet lys, så det er ikke engang i det synlige lysområde. Hver foton i det ultraviolette område har meget energi, nok til at skade hudcellerne og forårsage solskoldning. Faktisk skyldes de fleste former for solskoldning ikke varme, men den høje energi fra solens UV-stråler, som skader dine hudceller. Selv højere frekvenser af lys (eller elektromagnetisk stråling) kan trænge dybere ind i kroppen og forårsage endnu større skade. Røntgenstråler har så meget energi, at de kan trænge dybt ind i menneskekroppen og dræbe celler. Mennesker kan ikke se eller føle ultraviolet lys eller røntgenstråler. De kan kun vide, at de har været under et sådant højfrekvent lys, når de får en strålingsforbrænding. Områder, hvor det er vigtigt at dræbe bakterier, anvender ofte ultraviolette lamper til at ødelægge bakterier, svampe osv. Røntgenstråler bruges nogle gange til at dræbe kræftceller.
Kvantemekanikken begyndte, da man opdagede, at hvis en partikel har en bestemt frekvens, må den også have en bestemt mængde energi. Energien er proportional med frekvensen (E ∝ f). Jo højere frekvens, jo mere energi har en foton, og jo mere skade kan den gøre. Kvantemekanikken voksede senere til at forklare atomernes indre struktur. Kvantemekanikken forklarer også den måde, hvorpå en foton kan interferere med sig selv, og mange andre ting, som man aldrig havde forestillet sig i den klassiske fysik.
Sort til venstre er ultraviolet (høj frekvens); sort til højre er infrarødt (lav frekvens).
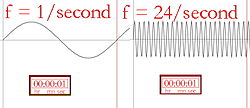
Billedlig beskrivelse af hyppigheden
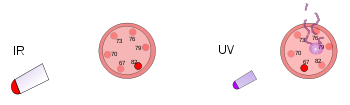
Til venstre er der et termometer af plastik under en lysende varmelampe. Denne infrarøde stråling opvarmer termometeret, men skader det ikke. Til højre bliver et andet plasttermometer ramt af et ultraviolet lys med lav intensitet. Denne stråling beskadiger termometeret, men opvarmer det ikke.
Kvantisering
Max Planck opdagede forholdet mellem frekvens og energi. Ingen før ham havde nogensinde gættet på, at frekvens er direkte proportional med energi (det betyder, at når den ene frekvens fordobles, fordobles den anden også). I det, der kaldes naturlige enheder, ville det tal, der repræsenterer en fotons frekvens, også repræsentere dens energi. Ligningen ville så være:
hvilket betyder, at energi er lig med frekvens.
Men på den måde, som fysikken udviklede sig, var der ingen naturlig forbindelse mellem de enheder, der blev brugt til at måle energi, og de enheder, der almindeligvis bruges til at måle tid (og dermed frekvens). Så den formel, som Planck fandt ud af for at få tallene til at passe sammen, var:
eller: energi er lig med h gange frekvens. Dette h er et tal, der kaldes Plancks konstant efter sin opfinder.
Kvantemekanikken er baseret på den viden, at en foton med en bestemt frekvens er ensbetydende med en foton med en bestemt mængde energi. Ud over denne sammenhæng kan en bestemt type atom kun afgive bestemte frekvenser af stråling, så det kan også kun afgive fotoner med en bestemt mængde energi.
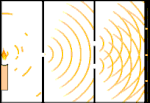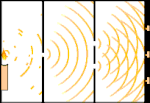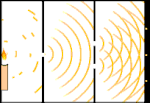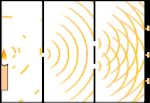
Dobbeltspalteforsøg: Lyset går fra lyskilden til venstre til frynserne (markeret i den sorte kant) til højre.
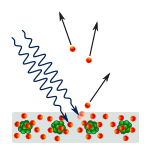
Fotoelektrisk effekt: Fotoner rammer metal, og elektroner skubbes væk.
Historie
Isaac Newton mente, at lys var lavet af meget små ting, som vi i dag ville kalde partikler (han kaldte dem "korpuscler"). Christiaan Huygens mente, at lyset bestod af bølger. Videnskabsfolk mente, at en ting ikke kan være en partikel og en bølge på samme tid.
Forskere lavede eksperimenter for at finde ud af, om lyset bestod af partikler eller bølger. De fandt ud af, at begge idéer var rigtige - lys var på en eller anden måde både bølger og partikler. Thomas Youngs dobbeltspalteeksperiment viste, at lyset må opføre sig som en bølge. Den fotoelektriske effekt, der blev opdaget af Albert Einstein, viste, at lys måtte opføre sig som partikler, der bar bestemte mængder energi, og at energierne var knyttet til deres frekvenser. Dette eksperimentelle resultat kaldes "bølge-partikel-dualitet" i kvantemekanikken. Senere fandt fysikerne ud af, at alt opfører sig både som en bølge og som en partikel, ikke kun lys. Denne effekt er dog meget mindre i store objekter.
Her er nogle af de personer, der opdagede de grundlæggende dele af kvantemekanikken: Max Planck, Albert Einstein, Satyendra Nath Bose, Niels Bohr, Louis de Broglie, Max Born, Paul Dirac, Werner Heisenberg, Wolfgang Pauli, Erwin Schrödinger, John von Neumann og Richard Feynman. De udførte deres arbejde i første halvdel af det 20. århundrede.

Fra venstre til højre: Max Planck, Albert Einstein, Niels Bohr, Louis de Broglie, Max Born, Paul Dirac, Werner Heisenberg, Wolfgang Pauli, Erwin Schrödinger, Richard Feynman.
Ud over Planck
Kvantemekanikkens formler og idéer blev udviklet for at forklare det lys, der kommer fra glødende brint. Kvanteteorien om atomet skulle også forklare, hvorfor elektronen forbliver i sin bane, hvilket andre idéer ikke kunne forklare. Det fulgte af de ældre ideer, at elektronen skulle falde ind i atomets centrum, fordi den i begyndelsen blev holdt i kredsløb af sin egen energi, men den ville hurtigt miste sin energi, når den kredser i sit kredsløb. (Dette skyldes, at man vidste, at elektroner og andre ladede partikler udsendte lys og mistede energi, når de ændrede hastighed eller drejede).
Brintlamper fungerer som neonlamper, men neonlamper har deres egen unikke gruppe af farver (og frekvenser) af lys. Forskere fandt ud af, at de kunne identificere alle grundstoffer ved hjælp af de lysfarver, de frembringer. De kunne bare ikke finde ud af, hvordan frekvenserne blev bestemt.
Derefter fandt en schweizisk matematiker ved navn Johann Balmer ud af en ligning, der angav, hvad λ (lambda for bølgelængde) ville være:
hvor B er et tal, som Balmer har bestemt til 364,56 nm.
Denne ligning fungerede kun for det synlige lys fra en brintlampe. Men senere blev ligningen gjort mere generel:
hvor R er Rydberg-konstanten, som er lig med 0,0110 nm−1 , og n skal være større end m.
Ved at indsætte forskellige tal for m og n er det let at forudsige frekvenser for mange typer lys (ultraviolet, synligt og infrarødt lys). For at se, hvordan det fungerer, skal du gå ind på Hyperphysics og gå ned efter midten af siden. (Brug H = 1 for hydrogen.)
I 1908 udviklede Walter Ritz Ritz-kombinationsprincippet, der viser, hvordan visse mellemrum mellem frekvenser gentager sig selv. Dette viste sig at være vigtigt for Werner Heisenberg flere år senere.
I 1905 brugte Albert Einstein Plancks idé til at vise, at en lysstråle består af en strøm af partikler kaldet fotoner. Energien af hver foton afhænger af dens frekvens. Einsteins idé er begyndelsen til kvantemekanikkens idé om, at alle subatomare partikler som elektroner, protoner, neutroner og andre er både bølger og partikler på samme tid. (Se billedet af atom med elektronen som bølger ved atom.) Dette førte til en teori om subatomare partikler og elektromagnetiske bølger kaldet bølge-partikel-dualitet. Her var partikler og bølger hverken det ene eller det andet, men havde visse egenskaber af begge dele.
I 1913 fik Niels Bohr den idé, at elektroner kun kunne indtage bestemte baner omkring atomkernen. Ifølge Bohrs teori kunne tallene m og n i ligningen ovenfor repræsentere baner. Bohrs teori sagde, at elektroner kunne begynde i en bane m og ende i en bane n, eller at en elektron kunne begynde i en bane n og ende i en bane m, så hvis en foton rammer en elektron, vil dens energi blive absorberet, og elektronen vil bevæge sig til en højere bane på grund af den ekstra energi. Ifølge Bohrs teori vil en elektron, hvis den falder fra en højere bane til en lavere bane, være nødt til at afgive energi i form af en foton. Fotonens energi vil svare til energiforskellen mellem de to baner, og fotonens energi gør, at den har en bestemt frekvens og farve. Bohrs teori gav en god forklaring på mange aspekter af subatomare fænomener, men kunne ikke svare på, hvorfor hver af de lysfarver, der produceres af glødende brint (og af glødende neon eller ethvert andet grundstof), har sin egen lysstyrke, og at lysstyrkeforskellene altid er de samme for hvert grundstof.

Da Niels Bohr kom med sin teori, vidste man det meste om det lys, der produceres af en brintlampe, men forskerne kunne stadig ikke forklare lysstyrken af de enkelte linjer, der produceres af glødende brint.
Werner Heisenberg påtog sig opgaven med at forklare lysstyrken eller "intensiteten" af hver linje. Han kunne ikke bruge nogen simpel regel som den, Balmer havde fundet frem til. Han var nødt til at bruge den klassiske fysiks meget vanskelige matematik, som udregner alting i form af ting som en elektrons masse (vægt), ladning (statisk elektrisk styrke) og andre små størrelser. Den klassiske fysik havde allerede svar på lysstyrken af de farvebånd, som en brintlampe frembringer, men den klassiske teori sagde, at der skulle være en kontinuerlig regnbue og ikke fire separate farvebånd. Heisenbergs forklaring er:
Der er en lov, der siger, hvilke lysfrekvenser lysende brint vil producere. Den skal forudsige, at frekvenserne er spredte, når de involverede elektroner bevæger sig mellem baner tæt på atomets kerne (centrum), men den skal også forudsige, at frekvenserne vil komme tættere og tættere på hinanden, når vi ser på, hvad elektronen gør, når den bevæger sig mellem baner længere og længere væk. Den skal også forudsige, at intensitetsforskellene mellem frekvenserne bliver tættere og tættere på hinanden, efterhånden som vi bevæger os udad. Hvor den klassiske fysik allerede giver de rigtige svar ved hjælp af ét sæt ligninger, skal den nye fysik give de samme svar, men ved hjælp af andre ligninger.
Den klassiske fysik bruger Joseph Fouriers matematiske metoder til at lave et matematisk billede af den fysiske verden, Den bruger samlinger af glatte kurver, der går sammen til én glat kurve, som i dette tilfælde giver intensiteter for lys af alle frekvenser fra noget lys. Men det er ikke rigtigt, fordi denne glatte kurve kun vises ved højere frekvenser. Ved lavere frekvenser er der altid isolerede punkter, og der er intet, der forbinder punkterne. Så for at lave et kort over den virkelige verden måtte Heisenberg foretage en stor ændring. Han var nødt til at gøre noget for kun at udvælge de tal, der ville stemme overens med det, der blev set i naturen. Nogle gange siger folk, at han "gættede" på disse ligninger, men han gættede ikke i blinde. Han fandt det, han havde brug for. De tal, som han beregnede, ville sætte prikker på en graf, men der ville ikke blive tegnet nogen linje mellem prikkerne. Og hvis man lavede en "graf" med prikker for hver enkelt beregning, ville man have spildt en masse papir og ikke have fået noget ud af det. Heisenberg fandt en måde at forudsige intensiteterne for forskellige frekvenser på en effektiv måde og at organisere disse oplysninger på en nyttig måde.
Ved blot at bruge den empiriske regel, som Balmer startede og Rydberg forbedrede, kan vi se, hvordan vi kan få et sæt tal, der ville hjælpe Heisenberg med at få det billede, han ønskede:
Reglen siger, at når elektronen bevæger sig fra en bane til en anden, vinder eller taber den enten energi, alt efter om den kommer længere væk fra centrum eller tættere på det. Så vi kan sætte disse baner eller energiniveauer ind som overskrifter langs toppen og siden af et gitter. Af historiske årsager kaldes den laveste bane for n, og den næste bane udad kaldes n - a, derefter kommer n - b osv. Det er forvirrende, at de brugte negative tal, når elektronerne faktisk fik mere energi, men sådan er det bare.
Da Rydberg-reglen giver os frekvenser, kan vi bruge denne regel til at sætte tal ind, afhængigt af hvor elektronen går hen. Hvis elektronen starter ved n og ender ved n, er den ikke rigtig gået nogen steder, så den har ikke vundet energi, og den har ikke mistet energi. Så frekvensen er 0. Hvis elektronen starter ved n-a og ender ved n, er den faldet fra en højere bane til en lavere bane. Hvis den gør det, så mister den energi, og den energi, den mister, viser sig som en foton. Fotonen har en vis mængde energi, e, og den er relateret til en bestemt frekvens f ved ligningen e = h f. Vi ved altså, at en bestemt ændring af kredsløb vil give en bestemt frekvens af lys, f. Hvis elektronen starter ved n og ender ved n - a, betyder det, at den er gået fra et lavere kredsløb til et højere kredsløb. Det sker kun, når en foton med en bestemt frekvens og energi kommer ind udefra, absorberes af elektronen og giver den energi, og det er det, der får elektronen til at gå ud til en højere bane. Så for at det hele skal give mening, skriver vi denne frekvens som et negativt tal. Der var en foton med en bestemt frekvens, og nu er den blevet taget væk.
Så vi kan lave et gitter som dette, hvor f(a←b) betyder den frekvens, der er involveret, når en elektron går fra energitilstand (bane) b til energitilstand a (igen, sekvenserne ser bagvendte ud, men det er sådan, de oprindeligt blev skrevet):
Raster af f
| Elektronertilstande | n | n-a | n-b | n-c | .... | |
| n | f(n←n) | f(n←n-a) | f(n←n-b) | f(n←n-c) | ..... | |
| n-a | f(n-a←n) | f(n-a←n-a) | f(n-a←n-b) | f(n-a←n-c) | ..... | |
| n-b | f(n-b←n) | f(n-b←n-a) | f(n-b←n-b) | f(n-b←n-c) | ..... | |
| overgang.... | ..... | ..... | ..... | ..... |
Heisenberg har ikke lavet gitteret på denne måde. Han lavede bare den matematik, der ville give ham de intensiteter, han søgte. Men for at gøre det var han nødt til at gange to amplituder (hvor højt en bølge måler) for at beregne intensiteten. (I klassisk fysik er intensiteten lig med amplituden i kvadrat.) Han lavede en mærkelig ligning for at løse dette problem, skrev resten af sin opgave, afleverede den til sin chef og tog på ferie. Dr. Born kiggede på sin sjove ligning, og den virkede lidt skør. Han må have tænkt: "Hvorfor gav Heisenberg mig denne mærkelige ting? Hvorfor er han nødt til at gøre det på denne måde?" Så gik det op for ham, at han så på en plan for noget, som han allerede vidste meget godt. Han var vant til at kalde det gitter eller den tabel, som vi kunne skrive ved f.eks. at lave al matematikken for frekvenser, for en matrix. Og Heisenbergs mærkelige ligning var en regel for at gange to af dem sammen. Max Born var en meget, meget god matematiker. Han vidste, at eftersom de to matricer (gitter), der blev ganget, repræsenterede forskellige ting (som f.eks. position (x,y,z) og impuls (mv)), så fik man ét svar, når man gangede den første matrix med den anden, og når man gangede den anden matrix med den første, fik man et andet svar. Selv om han ikke kendte til matrixmatematik, så Heisenberg allerede dette problem med "forskellige svar", og det havde generet ham. Men Dr. Born var så god en matematiker, at han så, at forskellen mellem den første matrixmultiplikation og den anden matrixmultiplikation altid ville involvere Plancks konstant, h, ganget med kvadratroden af negativ et, i. Så inden for få dage efter Heisenbergs opdagelse havde de allerede den grundlæggende matematik for det, som Heisenberg gerne kaldte "ubestemthedsprincippet". Med "ubestemthed" mente Heisenberg, at noget som en elektron bare ikke kan fastlåses, før den bliver fastlåst. Det er lidt ligesom en vandmand, der altid er i bevægelse og ikke kan være "på ét sted", medmindre man slår den ihjel. Senere fik folk for vane at kalde det "Heisenbergs usikkerhedsprincip", hvilket fik mange mennesker til at begå den fejl at tro, at elektroner og den slags ting virkelig er "et sted", men at vi bare er usikre på det i vores eget sind. Den idé er forkert. Det er ikke det, Heisenberg talte om. At have problemer med at måle noget er et problem, men det er ikke det problem, Heisenberg talte om.
Heisenbergs idé er meget svær at forstå, men vi kan gøre den tydeligere med et eksempel. Først vil vi begynde at kalde disse gitter for "matricer", fordi vi snart skal tale om matrixmultiplikation.
Lad os antage, at vi starter med to slags målinger, position (q) og impuls (p). I 1925 skrev Heisenberg en ligning som denne:

Han vidste det ikke, men denne ligning giver en plan for at skrive to matricer (gitter) og for at gange dem. Reglerne for multiplikation af en matrix med en anden er lidt rodet, men her er de to matricer i henhold til tegningen og derefter deres produkt:
Matrix af p
| Elektronertilstande | n-a | n-b | n-c | .... | |
| n | p(n←n-a) | p(n←n-b) | p(n←n-c) | ..... | |
| n-a | p(n-a←n-a) | p(n-a←n-b) | p(n-a←n-c) | ..... | |
| n-b | p(n-b←n-a) | p(n-b←n-b) | p(n-b←n-c) | ..... | |
| overgang.... | ..... | ..... | ..... | ..... |
Matrix af q
| Elektronertilstande | n-b | n-c | n-d | .... | |
| n-a | q(n-a←n-b) | q(n-a←n-c) | q(n-a←n-d) | ..... | |
| n-b | q(n-b←n-b) | q(n-b←n-c) | q(n-b←n-d) | ..... | |
| n-c | q(n-c←n-b) | q(n-c←n-c) | q(n-c←n-d) | ..... | |
| overgang.... | ..... | ..... | ..... | ..... |
Matrixen for produktet af de to ovenstående matricer som angivet i den relevante ligning i Heisenbergs artikel fra 1925 er:
| Elektronertilstande | n-b | n-c | n-d | ..... |
| n | A | ..... | ..... | ..... |
| n-a | ..... | B | ..... | ..... |
| n-b | ..... | ..... | C | ..... |
Hvor:
A=p(n←n-a)*q(n-a←n-b)+p(n←n-b)*q(n-b←n-b)+p(n←n-c)*q(n-c←n-b)+.....
B=p(n-a←n-a)*q(n-a←n-c)+p(n-a←n-b)*q(n-b←n-c)+p(n-a←n-c)*q(n-c←n-c)+.....
C=p(n-b←n-a)*q(n-a←n-d)+p(n-b←n-b)*q(n-b←n-d)+p(n-b←n-c)*q(n-d←n-d)+.....
og så videre.
Hvis matricerne blev vendt om, ville følgende værdier blive resultatet:
A=q(n←n-a)*p(n-a←n-b)+q(n←n-b)*p(n-b←n-b)+q(n←n-c)*p(n-c←n-b)+.....
B=q(n-a←n-a)*p(n-a←n-c)+q(n-a←n-b)*p(n-b←n-c)+q(n-a←n-c)*p(n-c←n-c)+.....
C=q(n-b←n-a)*p(n-a←n-d)+q(n-b←n-b)*p(n-b←n-d)+q(n-b←n-c)*p(n-d←n-d)+.....
og så videre.
Bemærk, hvordan ændringen af multiplikationsrækkefølgen trin for trin ændrer de tal, der faktisk multipliceres.

Synligt lys, der afgives af glødende brint. (Bølgelængder i nanometer.)
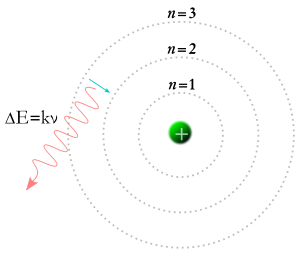
En elektron falder ned i en lavere bane, og der dannes en foton.
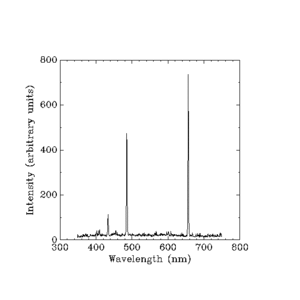
Udspaltede intensiteter i vilkårlige enheder
Ud over Heisenberg
Werner Heisenbergs arbejde syntes at bryde en blokering. Meget snart kom der mange forskellige andre måder at forklare tingene på fra folk som Louis de Broglie, Max Born, Paul Dirac, Wolfgang Pauli og Erwin Schrödinger. Hver af disse fysikeres arbejde er sin egen historie. Den matematik, som Heisenberg og tidligere personer brugte, er ikke særlig svær at forstå, men ligningerne blev hurtigt meget komplicerede, efterhånden som fysikerne gik dybere ind i atomernes verden.
Yderligere mysterier
I kvantemekanikkens tidlige dage foreslog Albert Einstein, at hvis den var rigtig, ville kvantemekanikken betyde, at der ville være "spooky action at a distance". Det viste sig, at kvantemekanikken havde ret, og at det, som Einstein havde brugt som begrundelse for at afvise kvantemekanikken, faktisk skete. Denne form for "spøgelsesagtig forbindelse" mellem visse kvantebegivenheder kaldes nu for "kvanteforvikling".
Når et eksperiment bringer to ting (fotoner, elektroner osv.) sammen, skal de have en fælles beskrivelse i kvantemekanikken. Når de senere adskilles, beholder de den samme kvantemekaniske beskrivelse eller "tilstand". I diagrammet er den ene egenskab (f.eks. "op"-spin) tegnet med rødt, og dens makker (f.eks. "ned"-spin) er tegnet med blåt. Det lilla bånd betyder, at når f.eks. to elektroner sættes sammen, deler parret begge egenskaber. Begge elektroner kan altså vise enten "up spin" eller "down spin". Når de senere adskilles, idet den ene bliver på Jorden og den anden tager til en planet omkring stjernen Alpha Centauri, har de stadig begge spin. Med andre ord kan hver af dem "beslutte" at vise sig som en elektron med opadgående spin eller en elektron med nedadgående spin. Men hvis nogen senere måler den anden, må den "beslutte" at vise sig som en elektron med modsat spin.
Einstein hævdede, at det var vanvittigt at tro, at det at tvinge en elektron til at vise sit spin på en eller anden måde ville få den anden elektron til at vise en modsat karakteristik. Han sagde, at de to elektroner hele tiden må have været spin-up eller spin-down, men at kvantemekanikken ikke kunne forudsige, hvilken egenskab hver elektron havde. At være ude af stand til at forudsige, kun at kunne se på den ene af dem med det rigtige eksperiment, betød, at kvantemekanikken ikke kunne redegøre for noget vigtigt. Derfor, sagde Einstein, havde kvantemekanikken et stort hul i den. Kvantemekanikken var ufuldstændig.
Senere viste det sig, at eksperimenter viste, at det var Einstein, der tog fejl.
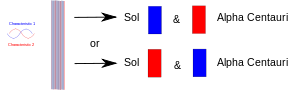
To sammenfiltrede partikler adskilles: en på Jorden og en på en fjern planet. Når man måler den ene af dem, tvinges den til at "beslutte", hvilken rolle den skal indtage, og den anden skal så indtage den anden rolle, når den (derefter) bliver målt.
Heisenbergs usikkerhedsprincip
I 1925 beskrev Werner Heisenberg usikkerhedsprincippet, som siger, at jo mere vi ved om, hvor en partikel befinder sig, jo mindre kan vi vide om, hvor hurtigt den bevæger sig og i hvilken retning den bevæger sig. Med andre ord, jo mere vi ved om hastigheden og retningen af noget lille, jo mindre kan vi vide om dets position. Fysikere taler normalt om impulsen i sådanne diskussioner i stedet for at tale om hastighed. Momentum er blot hastigheden af noget i en bestemt retning gange dets masse.
Årsagen til Heisenbergs usikkerhedsprincip er, at vi aldrig kan kende både en partikels position og impuls. Fordi lys er en rigelig partikel, bruges det til at måle andre partikler. Den eneste måde at måle det på er ved at lade lysbølgen prelle af på partiklen og registrere resultaterne. Hvis der anvendes en lysstråle med høj energi eller høj frekvens, kan vi sige præcist, hvor den befinder sig, men vi kan ikke sige, hvor hurtigt den bevægede sig. Det skyldes, at den høje energiphoton overfører energi til partiklen og ændrer partikelens hastighed. Hvis vi bruger en foton med lav energi, kan vi sige, hvor hurtigt den bevæger sig, men ikke hvor den er. Det skyldes, at vi bruger lys med en længere bølgelængde. Den længere bølgelængde betyder, at partiklen kan befinde sig hvor som helst langs bølgens strækning.
Princippet siger også, at der er mange målepar, for hvilke vi ikke kan kende begge målepar om en partikel (en meget lille ting), uanset hvor meget vi end prøver. Jo mere vi lærer om den ene af et sådant par, jo mindre kan vi vide om den anden.
Selv Albert Einstein havde svært ved at acceptere et så bizart koncept, og i en kendt debat sagde han: "Gud spiller ikke terninger". Hertil svarede den danske fysiker Niels Bohr som bekendt: "Einstein, du skal ikke fortælle Gud, hvad han skal gøre".
Anvendelse af kvantemekanikken
Elektroner omgiver alle atomkerner. Kemiske bindinger forbinder atomerne til molekyler. En kemisk binding forbinder to atomer, når elektroner deles mellem disse atomer. Kvantemekanikken er således den kemiske bindings fysik og kemien. Kvantemekanikken hjælper os med at forstå, hvordan molekyler skabes, og hvilke egenskaber de har.
Kvantemekanikken kan også hjælpe os med at forstå store ting, som f.eks. stjerner og endda hele universet. Kvantemekanikken er en meget vigtig del af teorien om, hvordan universet begyndte, kaldet Big Bang.
Alt, der består af stof, tiltrækkes af andet stof på grund af en grundlæggende kraft, der kaldes tyngdekraften. Einsteins teori, der forklarer tyngdekraften, kaldes den generelle relativitetsteori. Et problem i den moderne fysik er, at nogle af kvantemekanikkens konklusioner ikke synes at stemme overens med den generelle relativitetsteori.
Kvantemekanikken er den del af fysikken, der kan forklare, hvorfor al elektronisk teknologi fungerer, som den gør. Kvantemekanikken forklarer således, hvordan computere fungerer, fordi computere er elektroniske maskiner. Men designerne af den tidlige computerhardware fra omkring 1950 eller 1960 behøvede ikke at tænke på kvantemekanik. Konstruktørerne af radioer og fjernsyn dengang tænkte heller ikke på kvantemekanik. Derimod kræver de seneste års design af de mere kraftfulde integrerede kredsløb og computerhukommelsesteknologier kvantemekanik.
Kvantemekanikken har også muliggjort teknologier som f.eks:
Hvorfor kvantemekanik er svær at lære
Kvantemekanik er et udfordrende emne af flere grunde:
- Kvantemekanikken forklarer tingene på en helt anden måde end det, vi lærer om verden, når vi er børn.
- Forståelse af kvantemekanikken kræver mere matematik end algebra og simpel regning. Det kræver også matrixalgebra, komplekse tal, sandsynlighedsteori og partielle differentialligninger.
- Fysikere er ikke sikre på, hvad nogle af kvantemekanikkens ligninger fortæller os om den virkelige verden.
- Kvantemekanikken antyder, at atomer og subatomare partikler opfører sig på mærkelige måder, som slet ikke ligner noget, vi ser i vores hverdag.
- Kvantemekanikken beskriver ting, der er ekstremt små, så vi kan ikke se nogle af dem uden særligt udstyr, og vi kan slet ikke se mange af dem.
Kvantemekanikken beskriver naturen på en måde, der adskiller sig fra den måde, vi normalt tænker om videnskab på. Den fortæller os, hvor sandsynligt det er, at nogle ting vil ske, i stedet for at fortælle os, at de helt sikkert vil ske.
Et eksempel er Young's dobbeltspalteeksperiment. Hvis vi skyder enkelte fotoner (enkelte lysenheder) fra en laser mod et ark fotografisk film, vil vi se en enkelt lysplet på den fremkaldte film. Hvis vi lægger en metalplade ind imellem og laver to meget smalle spalter i pladen, vil vi se noget bemærkelsesværdigt, når vi affyrer mange fotoner mod metalpladen, og de skal igennem spalterne. Hele vejen igennem den fremkaldte film vil vi se en række lyse og mørke bånd. Vi kan bruge matematikken til at fortælle præcis, hvor de lyse bånd vil være, og hvor stærkt det lys var, der skabte dem, dvs. vi kan på forhånd sige, hvor mange fotoner der vil falde på hvert bånd. Men hvis vi bremser processen og ser, hvor hver foton lander på skærmen, kan vi aldrig på forhånd sige, hvor den næste foton vil dukke op. Vi kan vide med sikkerhed, at det er mest sandsynligt, at en foton vil ramme det midterste lyse bånd, og at det bliver mindre og mindre sandsynligt, at en foton vil dukke op på bånd længere og længere væk fra midten. Vi ved altså med sikkerhed, at båndene vil være lysstærkest i centrum og blive svagere og svagere længere væk. Men vi ved aldrig med sikkerhed, hvilken foton der vil komme ind i hvilket bånd.
En af de mærkelige konklusioner af kvantemekanikkens teori er "Schrödingers kat"-effekten. Visse egenskaber ved en partikel, f.eks. dens position, bevægelseshastighed, bevægelsesretning og "spin", kan man ikke tale om, før noget måler dem (en foton, der preller af på en elektron, ville f.eks. være en måling af dens position). Før målingen befinder partiklen sig i en "superposition af tilstande", hvor dens egenskaber har mange værdier på samme tid. Schrödinger sagde, at kvantemekanikken syntes at sige, at hvis noget (f.eks. en kats liv eller død) blev bestemt af en kvantebegivenhed, så ville dens tilstand være bestemt af den tilstand, der var resultatet af kvantebegivenheden, men kun på det tidspunkt, hvor nogen kiggede på kvantebegivenhedens tilstand. I tiden før kvantebegivenhedens tilstand bliver set på, er måske "den levende og den døde kat (undskyld udtrykket) [blandet eller smurt ud i lige store dele".
Reduceret Plancks konstant
Folk bruger ofte symbolet 

Eksempel
Partiklen i en 1-dimensional brønd er det mest enkle eksempel, der viser, at en partikels energi kun kan have bestemte værdier. Man siger, at energien er "kvantiseret". Brønden har nul potentiel energi inden for et område og har uendelig potentiel energi overalt uden for dette område. For det 1-dimensionelle tilfælde i 
Ved hjælp af differentialligninger kan vi regne ud, at 
eller som

Væggene i kassen betyder, at bølgefunktionen skal have en særlig form. Partiklens bølgefunktion må være nul når som helst væggene er uendeligt høje. Ved hver væg:
Overvej x = 0
- sin 0 = 0, cos 0 = 1. For at opfylde
skal cos-udtrykket fjernes. Derfor er D = 0
Overvej nu:
- ved
,
- Hvis
så er
for alle x. Denne løsning er ubrugelig.
- derfor må
være sandt, hvilket giver os
Vi kan se, at 
Relaterede sider
- Elektromagnetiske bølger
- Elektroner
- Foton
- Kvanteforvikling
- Kvantecomputer
- Kvantetilstand
- Schrödinger-ligningen
Mere læsning
- Cox, Brian; & Forshaw, Jeff (2011). Kvanteuniverset: Everything That Can Happen Does Happen. Allen Lane. ISBN 978-1-84614-432-5
Spørgsmål og svar
Spørgsmål: Hvad er kvantemekanik?
Svar: Kvantemekanik er en gren af fysikken, der forklarer, hvordan universet fungerer på en skala, der er mindre end atomerne. Den er også kendt som kvantefysik eller kvanteteori.
Spørgsmål: Hvad betyder udtrykket "kvante"?
A: Udtrykket "kvantum" kommer fra latin og betyder "hvor meget". Et kvantum af energi er den mindst mulige mængde (eller den mindst mulige ekstra mængde), og kvantemekanikken beskriver, hvordan denne energi bevæger sig eller interagerer.
Sp: Hvad er subatomare partikler?
Svar: Subatomare partikler er partikler, der udgør atomer, f.eks. protoner, neutroner og elektroner. De er endnu mindre end atomer.
Spørgsmål: Hvordan beskriver kvantemekanikken, hvordan disse partikler fungerer?
A: Kvantemekanikken giver matematiske regler til undersøgelse af subatomare partikler og elektromagnetiske bølger for at forstå deres adfærd og interaktioner med hinanden.
Spørgsmål: Hvad er bølge-partikel-dualitet?
A: Bølge-partikel-dualitet henviser til det faktum, at både partikler og bølger kan opføre sig som hinanden - de er ikke to forskellige enheder, men snarere noget, der ligner begge dele kombineret i ét fænomen.
Spørgsmål: Hvordan kan moderne fysik beskrives ved hjælp af kvantemekanikken?
Svar: Moderne fysik og kemi kan forklares ved at anvende kvantemekanikkens matematiske regler på dem.
Søge









