Nukleofil — definition, nukleofilitet og reaktioner
Forstå nukleofil: definition, nukleofilitet og reaktioner. Lær om elektronpar, Lewis-basers rolle, solvolyse og nukleofile substitutionsmekanismer med klare eksempler.
En nukleofil er en art, der afgiver et elektronpar til en elektrofil for at danne en kemisk binding i en reaktion. Alle molekyler eller ioner med et frit elektronpar kan være nukleofile. Dette elektronpar kaldes lone pair. Fordi nukleofile donerer elektroner, passer de ind i definitionen af Lewisbaser.
Nukleofil beskriver tiltrækningen af en nukleofil til kernen. Nukleofilitet, undertiden benævnt nukleofil styrke, henviser til et stofs nukleofile karakter og bruges ofte til at sammenligne tiltrækningen af atomer.
Neutrale nukleofile reaktioner med opløsningsmidler som f.eks. alkoholer og vand kaldes "solvolyse". Nukleofile stoffer kan deltage i nukleofile substitutionsreaktioner. I disse reaktioner tiltrækkes en nukleofil af en hel eller delvis positiv ladning.
Eksempler på nukleofiler
- Ioniske nukleofiler: OH-, RO-, CN-, NH2-, halidioner (I-, Br-, Cl-, F-), HS- osv.
- Neutrale nukleofiler: H2O, alkoholer (ROH), aminer (RNH2), thioler (RSH), carbonylbaser som enolater.
- Organometalliske nukleofiler: Grignard- og organolithium-reagenser (R-MgX, R-Li) — meget stærke nukleofiler, der angriber elektrofile carboncentre.
Faktorer der påvirker nukleofilitet
- Ladning: Negativt ladede arter er som regel mere nukleofile end deres neutrale analoger (f.eks. OH- > H2O).
- Elektronegativitet: Jo mindre elektronegativt et atom er, desto lettere afgiver det elektroner — ofte øget nukleofilitet.
- Polarisérbarhed: Store, let polariserbare anioner (f.eks. I-) reagerer ofte hurtigere med bløde elektrofile centre pga. bedre punktvis elektronoverlap.
- Sterisk hindring: Bulky nukleofiler (fx tert-butoxyd) reagerer langsommere fordi adgangen til det elektrofile centrum er begrænset.
- Resonans og delokalisering: Hvis det frie elektronpar er delokaliseret (f.eks. på en konjugeret base), mindskes nukleofiliteten betydeligt.
- Opløsningsmiddel: Meget vigtigt — i protiske opløsningsmidler (vand, alkoholer) solvatiseres små, hårde anioner (fx F-) kraftigt og bliver mindre nukleofile, så trenden ofte er I- > Br- > Cl- > F-. I aprotiske opløsningsmidler (DMF, DMSO, acetonnitril) følger nukleofiliteten i højere grad basisiteten: F- > Cl- > Br- > I-.
Nukleofilitet vs. basisitet
Det er vigtigt at skelne mellem nukleofilitet (en kinetisk egenskab: hvor hurtigt en art angriber et elektrofilt center) og basisitet (en termodynamisk egenskab: hvor stærkt en art binder en proton). Der er ofte sammenhæng — stærke baser er ofte også gode nukleofiler — men ikke altid. Forskelle opstår f.eks. når resonans eller solvatisering påvirker reaktionshastigheden forskelligt fra ligevægtsstabiliteten.
Typer af nukleofile reaktioner
- SN2 (bimolekylær nukleofil substitution): Direkte angreb på et elektrofile carbon med samtidig fraspaltning af en leaving group. Hastigheden afhænger af både nukleofil og substrategenskaber (f.eks. R-Br + OH- → R-OH + Br-).
- SN1 (unimolekylær substitution) og solvolyse: Først dannes en karbokation (hastighedsbestemmende), så angribes denne af en nukleofil. Her er nukleofilens styrke mindre afgørende for hastighedskonstanten; opløsningsmidlet og leaving group er vigtige.
- Nukleofil addition til carbonylgrupper: Aldehyder og ketoner kan angribes af nukleofiler som hydrid, alkoxider eller cyanid (fx addition af CN- til en carbonyl).
- Michael-addition (konjugeret addition): Nukleofiler kan tilføje til α,β-umættede carbonylforbindelser.
- Nukleofil aromatisk substitution (SNAr): Kræver ofte elektrontrækende grupper på ringen for at stabilisere mellemtrinet.
Strategier i syntese og praktiske bemærkninger
- Valg af opløsningsmiddel er ofte afgørende: brug aprotiske opløsningsmidler for at styrke reaktiviteten af små anioniske nukleofiler.
- Sterisk tunge nukleofiler kan fremme E2-eliminering frem for SN2-substitution på primære/sekundære substrater.
- HSAB-princippet (hård vs. blød) hjælper med at forudsige præferencer: bløde nukleofiler foretrækker bløde elektrofile centre (fx I- angriber bløde C-eller S-centre), mens hårde nukleofiler reagerer bedre med hårde elektrofile centre (fx H+).
- I retrosyntese anvendes nukleofile reaktioner ofte til at bygge carbon–carbon og carbon–heteroatom-bindinger (f.eks. cyanid for at introducere nitril, organometalliske reagenser for C–C-bindingsdannelse).
Opsummering: Nukleofiler er elektronpar-donorer (Lewis-baser) som reagerer med positivt ladede eller elektronfattige centre. Deres effektivitet bestemmes af ladning, polariserbarhed, opløsningsmiddel, sterik og elektronisk delokalisering. Forståelse af disse faktorer gør det muligt at forudsige og styre reaktioner som SN1, SN2, addition til carbonylforbindelser og andre vigtige transformations i organisk kemi.
Historie
Udtrykkene nukleofil og elektrofil blev indført af Christopher Kelk Ingold i 1929 og erstattede de udtryk kationoid og anionoid, som A. J. Lapworth havde foreslået tidligere i 1925.
Ordet nukleofil er afledt af nucleus og det græske ord φιλος, philos for kærlighed.
Egenskaber
Generelt gælder det inden for en række i det periodiske system, at jo mere basisk ionen er (jo højere pKa for den konjugerede syre), jo mere reaktiv er den som nukleofil. Inden for en given gruppe er polariserbarhed vigtigere ved bestemmelsen af nukleofiliciteten. Med andre ord, jo lettere det er at forvrænge elektronskyen omkring et atom eller molekyle, jo lettere vil det reagere. F.eks. er jodidionen (I−) mere nukleofil end fluoridionen (F−).
Typer af nukleofile stoffer
Eksempler på nukleofile stoffer er anioner som Cl− eller en forbindelse med et enkelt elektronpar som NH3 (ammoniak).
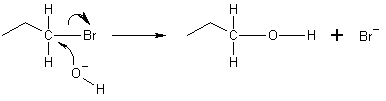
I eksemplet nedenfor afgiver hydroxidionens ilt et elektronpar for at binde sig til kulstoffet i enden af bromopropanmolekylet. Bindingen mellem kulstoffet og bromet gennemgår derefter en heterolytisk spaltning, hvor bromatomet tager den donerede elektron og bliver til bromidionen (Br−). Dette er en NS2-reaktion, der sker ved backside attack. Det betyder, at hydroxidionen angriber kulstofatomet fra den anden side, præcis modsat bromionen. På grund af dette backside-angreb resulterer NS2-reaktioner i en omvendt konfiguration af elektrofilen. Hvis elektrofilen er chiral, beholder den typisk sin chiralitet, selv om NS2-produktets konfiguration er omvendt i forhold til den oprindelige elektrofil (Walden-inversion).
En ambident nukleofil er en nukleofil, der kan angribe fra to eller flere steder, hvilket resulterer i to eller flere produkter. Thiocyanat-ionen (SCN−) kan f.eks. angribe enten fra S eller N. Derfor fører NS2-reaktionen af et alkylhalogenid med SCN −ofte til en blanding af RSCN (et alkylthiocyanat) og RNCS (et alkylisothiocyanat). Lignende blandinger vil forekomme i Kolbe-nitrilsyntesen.
Kulstof-nukleofile stoffer
Alkylmetalhalogenider er kulstofnukleofile, der findes i Grignard-reaktionen, Blaise-reaktionen, Reformatsky-reaktionen og Barbier-reaktionen, organolithiumreagenser og anioner af en terminal alkyn.
Enoler er også nukleofile kulstofsyrer. Dannelsen af en enol katalyseres af syre eller base. Enoler er ambident nukleofile, men er generelt nukleofile ved det kulstofatom, der ligger ved siden af kulstofatomer med dobbeltbinding (alfa-kulstofatom). Enoler anvendes almindeligvis i kondensationsreaktioner, herunder Claisen-kondensation og aldolkondensationsreaktioner.
Oxygen nukleofile
Eksempler på iltnukleofile stoffer er vand (2HO), hydroxid-anioner, alkoholer, alkoxid-anioner, hydrogenperoxid og carboxylat-anioner.
Svovl nukleofile stoffer
Af svovlnukleofile nukleofile anvendes hyppigst svovlbrinte og salte heraf, thioler (RSH), thiolatanioner (RS−), anioner af thiolkarboxylsyrer (RC(O)-S−) og anioner af dithiocarbonater (RO-C(S)-S−) og dithiocarbamater (2RN-C(S)-S). −
Generelt er svovl meget nukleofilt på grund af dets store størrelse, som gør det let polariserbart, og dets enlige elektronpar er let tilgængelige.
Nitrogen-nukleofile
Nitrogen-nukleofile stoffer omfatter ammoniak, azid, aminer og nitritter.
Relaterede sider
- Elektrofil
- Lewis base
Spørgsmål og svar
Q: Hvad er en nukleofil?
A: En nukleofil er en art, der afgiver et elektronpar til en elektrofil for at danne en kemisk binding i en reaktion.
Q: Hvilken type molekyler eller ioner kan være nukleofile?
A: Alle molekyler eller ioner med et frit elektronpar kan være nukleofile.
Q: Hvad kaldes det par elektroner, som nukleofiler donerer?
A: Elektronparret kaldes lone pair.
Q: Hvilken kategori passer nukleofiler ind i?
A: Nukleofiler passer ind i kategorien Lewis-baser, fordi de donerer elektroner.
Q: Hvad beskriver udtrykket "nukleofil"?
A: Udtrykket "nukleofil" beskriver tiltrækningen af en nukleofil til kernerne.
Q: Hvad refererer udtrykket "nukleofilicitet" til?
A: Udtrykket "nukleofilicitet" henviser til et stofs nukleofile karakter og bruges ofte til at sammenligne tiltrækningen af atomer.
Q: Hvad er "solvolyse"-reaktioner?
A: Neutrale nukleofile reaktioner med opløsningsmidler som alkoholer og vand kaldes "solvolyse".
Søge