Alkyn (alkyner/acetylener) – definition, struktur og reaktivitet
Lær om alkyner (acetylener): struktur, reaktivitet, egenskaber, syntese og reaktioner — fra acetylen til additions- og reductionsmuligheder.
Alkyn (også kaldet acetylener) er en type molekyle, der indeholder en tripelbinding mellem to kulstofatomer. Den generelle formel for acykliske alkynes er CnH2n-2. Det mindste alkyn er acetylen (ethyn), med formlen C2H2. Alkyner er typisk hydrofobiske: de opløses godt i organiske opløsningsmidler, men dårligt i vand. Hvert efterfølgende homologe medlem adskiller sig fra det foregående ved en -CH2-enhed, ofte skrevet som "-CH "2.
Struktur og elektronisk opbygning
Kulstofatomerne i en C≡C-tripelbinding er sp-hybridiserede, hvilket giver en lineær geometri omkring bindingen (180°). Tripelbindingen består af én σ-binding og to π-bindinger. Den sp-hybridisering betyder også, at C–H i terminale alkynes har en karakter af sp–H, hvilket gør disse protoner relativt mere sure end protoner bundet til sp2- eller sp3-kulstoffer.
Fysiske egenskaber
Alkyner er upolære eller svagt polære og har typisk højere kogepunkter end tilsvarende alkaner af samme masse pga. øget π-interaktion. Terminale alkynes har en karakteristisk ≡C–H vibrationsbølge i IR omkring 3300 cm−1, og C≡C-stræk ses typisk mellem 2100–2260 cm−1.
Reaktivitet
Alkyner er ofte mere reaktive end tilsvarende kulbrinter og i mange tilfælde mere reaktive end alkener i bestemte reaktionstyper. Nogle vigtige reaktionstyper:
- Deprotonering af terminale alkynes: Terminale alkynes kan afgive protonerne relativt let ved behandling med en stærk base (fx NaNH2 eller organolithium-forbindelser). Det danner et acetylid-anion, som er en stærk nukleofil anvendt til dannelse af nye C–C-bindinger.
- Additionsreaktioner: Alkynes gennemgår mange additionsreaktioner, f.eks. hydrogenation til alkaner eller alkenes. Partial hydrogenation kan gives enten cis- eller trans-alkener afhængigt af reduktionsmetoden (katalytisk hydrogenation med Lindlar‑katalysator giver cis; dissolving‑metal reduktion (Na/NH3) giver typisk trans).
- Hydrering og hydroboration-oxidation: Hydrering af alkynes (ofte katalyseret af H2O/H+/Hg2+) leder typisk til en keton via en enol‑tautomeri (Markovnikov-produkt). Hydroboration-oxidation af terminale alkynes kan give aldehyder (anti‑Markovnikov) efter tautomeri.
- Halogenering og elektrofiler: Alkynes kan halogeneres eller addere andre electrophiler over π-systemet og danne di‑ eller tetrahalogenerede produkter.
- Pericykliske reaktioner: Alkynes deltager aktivt i pericykliske reaktioner, eksempelvis [2+2+2]-cykloadditioner og andre cykloadditioner, som udnyttes i syntese af aromatiske og heteroaromatiske systemer.
Syntetiske anvendelser
Alkynes er vigtige byggesten i organisk syntese: acetylid-anioner bruges til at forlænge carbonkæder ved nukleofile substitutioner, alkynes fungerer som moderne funktionelle grupper i late-stage-modifikation af lægemidler og materialer og indgår i fremstilling af specialkemikalier. Industrielt er acetylen bl.a. anvendt i svejsning (oxy‑acetylen), samt som udgangspunkt i visse polymerisations‑ og kemiindustriprocesser.
Spektroskopisk identifikation
Typiske signalsignaturer omfatter IR: ≡C–H stretch ≈3300 cm−1 (terminal alkynes) og C≡C stretch ≈2100–2260 cm−1. I 1H‑NMR optræder den acetyleniske proton typisk omkring 2–3 ppm (afhængig af substituenter), og i 13C‑NMR ligger sp‑hybridiserede kulstoffer ofte i området ca. 70–90 ppm.
Sikkerhed
Acetylen er brandfarligt og kan være eksplosivt ved højt tryk eller i visse blandinger med luft — håndtering kræver passende sikkerhedsforanstaltninger. Generelt bør alkynes opbevares og håndteres i overensstemmelse med gældende sikkerhedsdatablade og laboratorieprocedurer.
Samlet set er alkynes alsidige og reaktive funktionelle grupper i organisk kemi, med karakteristisk lineær geometri, særlige spektroskopiske træk og en bred vifte af anvendelser i syntese og industri.
Struktur
Alkyner har en 180 graders vinkel mellem de to kulstofatomer. Af denne grund kan de ikke lide at indgå i en cyklisk forbindelse. Nedenfor er vist nogle eksempler på alkyner.
| Funktionelle grupper |
|
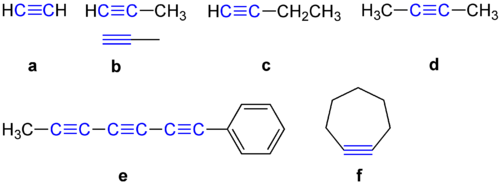
Eksempler på alkyner
Spørgsmål og svar
Spørgsmål: Hvad er en alkyn?
A: Et alkyn er et molekyle, der har en tripelbinding mellem to kulstofatomer.
Sp: Hvad er den generelle formel for alkyner?
Svar: Den generelle formel for alkyner er CnH2n-2.
Sp: Hvad er den mindste alkyn?
Svar: Det mindste alkyn er acetylen, også kaldet ethyn.
Sp: Er alkyner hydrofobiske eller hydrofiliske?
Svar: Alkyner er hydrofobiske, hvilket betyder, at de opløses godt i organiske opløsningsmidler, men ikke i vand.
Sp: Hvordan adskiller de enkelte på hinanden følgende medlemmer af en alkyn sig fra hinanden?
Svar: Hvert enkelt medlem af et alkyn adskiller sig fra hinanden ved sin molekylære formularitet med "-CH2".
Spørgsmål: Er alkyner mere reaktive end almindelige kulbrinter?
Svar: Ja, alkyner er mere reaktive end almindelige kulbrinter som f.eks. alkener i mange reaktioner.
Spørgsmål: Hvad kan man gøre med et alkyn i slutningen af et molekyle?
A: Hvis alkynen befinder sig i slutningen af et molekyle, kan den let fjernes ved protonering med en stærk base og derefter anvendes i additionsreaktioner, f.eks. ved at blive tilføjet til en keton.
Søge