SN2-reaktion: Definition og mekanisme for bimolekylær nukleofil substitution
Få en klar forklaring af SN2-reaktionen: definition, mekanisme, hastighedsbestemmende trin, nukleofil og leaving group samt stereokemiske konsekvenser i én letforståelig guide.
SN 2-reaktionen (også kendt som bimolekylær nukleofil substitution) er en substitutionsreaktion i organisk kemi. Det er en type nukleofil substitution, hvor et ensomt par fra en nukleofil angriber et elektronmanglende elektrofilt center og binder sig til det. Herved udstødes en anden gruppe, der kaldes en "leaving group". Den indgående gruppe erstatter altså den udgående gruppe i ét trin. Da to reagerende arter er involveret i det langsomme, hastighedsbestemmende trin af reaktionen, fører dette til navnet bimolekylær nukleofil substitution eller SN 2. Blandt uorganiske kemikere er SN 2-reaktionen ofte kendt som udvekslingsmekanismen.
Mekanisme og overgangstilstand
SN 2-reaktionen forløber concerted (i ét trin) uden stabile intermediater. Nukleofilen angriber bagfra i forhold til leaving group, hvilket fører til en overgangstilstand, hvor det elektrofilt centrum er delvist bundet til både den indgående nukleofil og den udgående gruppe. Overgangstilstanden kan beskrives som pentacoordineret eller "dobbeltbundet" på et øjeblik—der er delvise bindinger til både nukleofil og leaving group. Når reaktionen fuldføres, forlader leaving group, og produktet dannes.
Hastighed (kinetik)
SN 2-reaktioner følger andenordens kinetik med hastighedsloven:
rate = k [nukleofil] [substrat]
Det betyder, at hastigheden er proportional med koncentrationerne af både nukleofil og det elektrofilt centrum (typisk et alkohol derivat som en alkylhalid).
Faktorer der påvirker reaktionshastigheden
- Substratets struktur: Methyl- og primære centrum reagerer hurtigst. Sekundære centrum reagerer langsommere pga. sterisk hindring. Tertiære centrum reagerer næsten ikke via SN 2 på grund af kraftig sterisk afskærmning.
- Nukleofilens styrke: Stærkere nukleofiler (typisk negative ioner, mindre sterisk hæmmede) fremmer SN 2. Nucleofilens basisitet og polariserbarhed spiller ind.
- Leaving group: En god leaving group er en svag base og stabil som anion (f.eks. I– > Br– > Cl–; OH– er dårlig uden aktivering).
- Solvent: Polar aprotiske opløsningsmidler (f.eks. acetone, DMF, DMSO) øger hastigheden for anioniske nukleofiler, fordi de ikke hydrogenbinder stærkt til nukleofilen. Protic solventer (f.eks. vand, alkohol) kan nedsætte nukleofilens reaktivitet ved solvatisering.
- Steriske effekter: Store substituenter omkring reaktionscentret blokerer for backside attack og nedsætter hastigheden.
- Resonans og elektrontrækning: Allyl- og benzyl-centre er ofte mere reaktive end simple alifatiske centre pga. stabilisering af overgangstilstanden; elektrontrækkende grupper kan gøre centrum mere elektrofil.
Stereokemi
En karakteristisk egenskab ved SN 2 er stereospecifik inversion af konfiguration ved et chiralt center (Walden-inversion). Fordi nukleofilen angriber fra den modsatte side af leaving group, får man en inversion af den tredimensionelle opbygning, hvilket gør reaktionen nyttig til selektiv stereokemisk syntese.
Sammenligning med SN1
- SN2 er concerted og bimolekylær (rate afhænger af begge reaktanter).
- SN1 forløber via et karbokationisk mellemtrin (unisubstitueret trin), og hastigheden erordnet efter [substrat] alene; ofte foretrækkes tertiære centre i SN1.
- Stereokemisk: SN2 giver inversion, SN1 ofte racemisering (pga. plan karbokation der kan angribes fra begge sider).
Praktiske eksempler
- Williamson-ethersyntese: en alkoxid reagerer med et primært alkylhalid via SN2 for at danne en ether.
- Cyanid substitution: R–Br + CN– → R–CN (ofte hurtig SN2 for primære og sekundære halider).
- Hydroxid substitution: R–X + OH– → R–OH (kræver ofte gode leaving groups eller aktivering).
Yderligere betragtninger
SN 2-reaktioner er centrale i organisk syntese pga. deres forudsigelige kinetik og stereokemiske konsekvenser. I praksis vælger man reaktanter og opløsningsmiddel for at maksimere hastighed og ønsket stereokemi—f.eks. bruge polar aprotiske opløsningsmidler for at fremme reaktiviteten af anioniske nukleofiler, og vælge primære substrater for at undgå konkurrerende mekanismer. Dertil kan ionstyrke, temperatur og tilstedeværelse af komplekserende kationer (f.eks. kronen-ethers eller 18-crown-6) også ændre reaktionsforløbet.
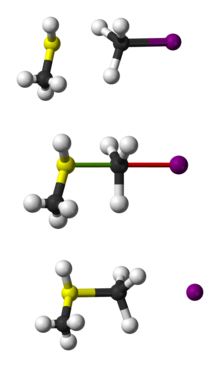
Kugle og pind repræsentation af SN 2-reaktionen af CH3 SH med CH3 I
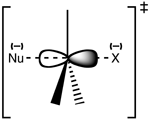
Struktur af overgangstilstanden SN 2
Reaktionsmekanisme
Reaktionen finder oftest sted ved et alifatisk sp3 kulstofcenter med en elektronegativ, stabil afgangsgruppe knyttet til det - "X" - ofte et halogenidatom. Bruddet af C-X-bindingen og dannelsen af den nye C-Nu-binding sker samtidig og danner en overgangstilstand, hvor kulstoffet under nukleofilt angreb er pentakoordineret og ca. sp2 hybridiseret. Nukleofilen angriber kulstoffet 180° i forhold til den udgående gruppe, da dette giver det bedste overlap mellem nukleofilens ensomme par og C-X σ* antibindingsorbitalet. Den udgående gruppe skubbes derefter væk fra den modsatte side, og produktet dannes.
Hvis substratet under nukleofilt angreb er chiralt, kan dette føre til en inversion af stereokemien, kaldet Walden-inversionen, men ikke nødvendigvis.
I et eksempel på SN 2-reaktionen resulterer angrebet af OH −(nukleofil) på en bromethan (elektrofil) i ethanol, med bromid udskudt som afgangsgruppe:
En SN 2-reaktion finder sted, hvis angrebsvejen på bagsiden ikke er blokeret af andre atomer i molekylet (sterisk hindret af substituenter på substratet). Så denne mekanisme forekommer normalt ved et uhindret primært kulstofcenter. Hvis der er sterisk trængsel på substratet i nærheden af den udgående gruppe, f.eks. ved et tertiært kulstofcenter, vil substitutionen anvende en S N1-mekanisme snarere end en SN 2-mekanisme (en SN 1-mekanisme ville også være mere sandsynlig med blokerede molekyler, fordi der kunne dannes et tilstrækkeligt stabilt carbocation-mellemled).
I koordinationskemi foregår associerende substitution efter en lignende mekanisme som SN 2.
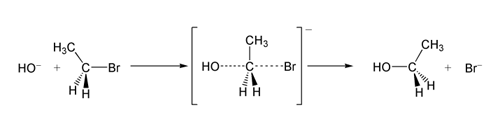
SN 2 reaktion af bromethan med hydroxidion.
Faktorer, der påvirker reaktionshastigheden
Fire faktorer påvirker reaktionshastigheden:
- Underlag. Substratet spiller den vigtigste rolle i bestemmelsen af reaktionshastigheden. Det skyldes, at nukleofilen angriber fra bagsiden af substratet og dermed bryder bindingen mellem kulstof og den kulstofafgivende gruppe og danner bindingen mellem kulstof og nukleofil. For at maksimere hastigheden af SN 2-reaktionen skal bagsiden af substratet derfor være så uhindret som muligt. Samlet set betyder dette, at methyl- og primære substrater reagerer hurtigst, efterfulgt af sekundære substrater. Tertiære substrater deltager ikke i SN 2-reaktioner på grund af sterisk hindring.
- Nukleofil. Ligesom substratet påvirker sterisk hindring nukleofilens styrke. Methoxid-anionen er f.eks. både en stærk base og nukleofil, fordi den er en methyl-nukleofil og dermed meget uhindret. Tert-butoxid er derimod en stærk base, men en dårlig nukleofil, fordi dens tre methylgrupper hindrer dens tilgang til kulstoffet. Nukleofils styrke påvirkes også af ladning og elektronegativitet: nukleofiliteten øges med stigende negativ ladning og faldende elektronegativitet. F.eks. er OH- en bedre nukleofil end vand, og I- er en bedre nukleofil end Br- (i polære protiske opløsningsmidler). I et polært aprotisk opløsningsmiddel stiger nukleofiliteten en kolonne opad i det periodiske system, da der ikke er nogen hydrogenbinding mellem opløsningsmidlet og nukleofilen. I dette tilfælde afspejler nukleofiliciteten basiskheden. I- ville derfor være en svagere nukleofil end Br- , fordi det er en svagere base.
- Opløsningsmiddel. Opløsningsmidlet påvirker reaktionshastigheden, fordi opløsningsmidler kan omgive en nukleofil eller ej og dermed hæmme eller ikke hæmme dens tilgang til kulstofatomet. Polære aprotiske opløsningsmidler, som f.eks. tetrahydrofuran, er bedre opløsningsmidler til denne reaktion end polære protiske opløsningsmidler, fordi polære protiske opløsningsmidler opløses af opløsningsmidlets hydrogenbinding til nukleofilet. Dette forhindrer den i at angribe kulstoffet med den udgående gruppe.
- Forlader gruppen. Den afgående gruppe påvirker reaktionshastigheden. Jo mere stabil afgangsgruppen er, jo mere sandsynligt er det, at den vil tage de to elektroner fra sin kulstof-afgangsgruppe-binding med sig, når nukleofilen angriber kulstoffet. Jo svagere den afgående gruppe er som konjugeret base, jo bedre er den afgående gruppe derfor. På samme måde gælder det, at jo stærkere den tilsvarende syre er, jo bedre er den afgående gruppe. Eksempler på gode afgangsgrupper er halogenider (undtagen fluorid) og tosylat. Men HO- og H2 N- er ikke gode afgangsgrupper.
Reaktionskinetik
Hastigheden af en SN 2-reaktion er af anden orden, da det hastighedsbestemmende trin afhænger af nukleofilkoncentrationen [Nu− ] såvel som substratkoncentrationen [RX].
r = k[RX][Nu− ]
Dette er en væsentlig forskel mellem SN 1 og SN 2 mekanismerne. I SN 1-reaktionen angriber nukleofilen, efter at det hastighedsbegrænsende trin er overstået. Men i en SN 2-reaktion tvinger nukleofilen den afgående gruppe væk i det begrænsende trin. Med andre ord afhænger SN 1-reaktionens hastighed kun af substratets koncentration, mens SN 2-reaktionens hastighed afhænger af koncentrationen af både substratet og nukleofilen. I tilfælde, hvor begge mekanismer er mulige (f.eks. ved et sekundært kulstofcenter), afhænger mekanismen af opløsningsmiddel, temperatur, koncentrationen af nukleofil eller af den udgående gruppe.
SN 2-reaktioner foretrækkes generelt i primære alkylhalogenider eller sekundære alkylhalogenider med et aprotisk opløsningsmiddel. De forekommer med en ubetydelig hastighed i tertiære alkylhalogenider på grund af sterisk hindring.
SN 2 og SN 1 er to yderpunkter på en glidende skala af reaktioner. Det er muligt at finde mange reaktioner, som har både SN 2 og SN 1 karakter i deres mekanismer. F.eks. er det muligt at få dannet et kontakt ionpar fra et alkylhalogenid, hvor ionerne ikke er helt adskilt. Når disse undergår substitution, vil stereokemien blive omvendt (som i SN 2) for mange af de reagerende molekyler, men nogle få kan vise bevarelse af konfigurationen. SN 2-reaktioner er mere almindelige end SN 1-reaktioner.
E2-konkurrence
En almindelig bivirkningsreaktion, der finder sted ved SN 2-reaktioner, er E2-eliminering: den indkommende anion kan fungere som base i stedet for nukleofil, fjerne en proton og føre til dannelse af alken. Denne effekt kan demonstreres i gasfasereaktionen mellem en sulfonat og et simpelt alkylbromid, der finder sted i et massespektrometer:

Med ethylbromid er reaktionsproduktet overvejende et substitutionsprodukt. Når den steriske hindring omkring det elektrofiliske center øges, som med isobutylbromid, er substitution ugunstigt stillet, og eliminering er den fremherskende reaktion. Andre faktorer, der begunstiger eliminering, er basens styrke. Med det mindre basiske benzoatsubstrat reagerer isopropylbromid med 55% substitution. Generelt følger gasfasereaktioner og opløsningsfasereaktioner af denne type de samme tendenser, selv om opløsningsmiddelvirkningerne i den første er bortfaldet i den anden.
Rundkørselsmekanisme
En udvikling, der tiltrak sig opmærksomhed i 2008, vedrører en SN 2 rundkredsmekanisme, der er observeret i en gasfase-reaktion mellem kloridioner og methyljodid med en særlig teknik kaldet crossed molecular beam imaging. Når kloridionerne har tilstrækkelig hastighed, er energien af de resulterende jodidioner efter kollisionen meget lavere end forventet, og det er en teori, at der går energi tabt som følge af en fuldstændig rundkørsel af methylgruppen omkring jodatomet, før den egentlige forskydning finder sted.
Relaterede sider
- Substitutionsreaktion
- SN 1 reaktion
Spørgsmål og svar
Q: Hvad er SN2-reaktionen?
A: SN2-reaktionen er en substitutionsreaktion i organisk kemi, hvor en nukleofil angriber et elektrofilt center med elektronmangel, uddriver en afgangsgruppe og derefter erstatter den i ét trin.
Q: Hvilken slags substitutionsreaktion er SN2-reaktionen?
A: SN2-reaktionen er en type nukleofil substitutionsreaktion.
Q: Hvor mange reaktionsarter er involveret i det langsomme, hastighedsbestemmende trin i SN2-reaktionen?
A: To reaktionsarter er involveret i det langsomme, hastighedsbestemmende trin i SN2-reaktionen.
Q: Hvad er betydningen af navnet "bimolekylær nukleofil substitution" for SN2-reaktionen?
A: Navnet "bimolekylær nukleofil substitution" for SN2-reaktionen henviser til det faktum, at to reagerende arter er involveret i det langsomme, hastighedsbestemmende trin i reaktionen.
Q: Hvad er en nukleofil i forbindelse med SN2-reaktionen?
A: En nukleofil er et molekyle eller en ion, der afgiver et ensomt elektronpar for at danne en kemisk binding.
Q: Hvad er en elektrofil i forbindelse med SN2-reaktionen?
A: En elektrofil er et molekyle eller en ion, der accepterer et par elektroner for at danne en kemisk binding.
Q: Hvad er SN2-reaktionen ofte kendt som blandt uorganiske kemikere?
A: Blandt uorganiske kemikere er SN2-reaktionen ofte kendt som udvekslingsmekanismen.
Søge