Elektrofil i kemi: Definition, egenskaber og eksempler
Elektrofil i kemi: Få klar definition, nøgleegenskaber og illustrative eksempler på elektrofiler, deres reaktivitet og rolle i additions- og substitutionsreaktioner.
I kemi er en elektrofil et molekyle eller et atom, der gerne tager elektroner fra et andet molekyle eller atom. Mange elektrofiler har en positiv ladning. De kaldes også Lewis-syrer — dvs. stoffer, der kan acceptere et elektronpar. Nogle eksempler på elektrofiler er molekyler, hvor atomerne har en stor forskel i elektronegativitet, som HCl eller en carbonyl, eller også oxidationsmidler.
Egenskaber og hvad der gør et stof elektrofilisk
En elektrofil er karakteriseret ved et elektronfattigt center, som kan
- acceptere et elektronpar fra en nukleofil og danne en kovalent binding;
- have en positiv formel ladning (f.eks. en karbokation), eller en delvis positiv ladning på grund af elektronegativitetsforskelle (f.eks. C i en carbonylgruppe);
- have en lavtliggende LUMO (lav energitilgængelig antibindende orbital), hvilket gør det lettere at modtage elektroner;
- være påvirket af induktive og resonans effekter — elektrontrækende grupper øger ofte elektrofiliciteten, mens resonansdelokalisering kan reducere reaktiviteten mod nukleofiler;
- sterisk hindring mindsker ofte reaktiviteten, fordi nukleofiler har sværere ved at nå det elektrofile center;
- solvent- og katalyse-effekter: polære protiske eller aprotiske opløsningsmidler samt Lewis-syre-katalysatorer (f.eks. AlCl3, BF3) kan øge eller mindske elektrofiliciteten afhængigt af reaktionen.
Typiske elektrofiler — eksempler
- Protoner (H+), som i syrereaktioner (fx HCl) — meget kraftige, enkle elektrofiler.
- Carbonylcarbon (C=O) i aldehyder og ketoner — karbonylcarbon er delvist positivt og angribes ofte af nukleofiler (se også carbonyl).
- Karbocationer (R–C+–R) — klassiske stærke elektrofiler i reaktioner som SN1.
- Haloniumioner (f.eks. Br+ i bromering af alkener) og molekyler som Br2/Cl2 i tilstedeværelse af alkener.
- Nitroniumion (NO2+) — elektrofil i nitrering af aromatiske ringer.
- Oxidationsmidler og andre elektronmangel-agenter, som i visse reaktioner kan opføre sig som elektrofiler (se oxidationsmidler).
Hvordan elektrofiler reagerer — reaktionstyper
- Additionsreaktioner — nukleofilen angriber et elektrofilisk centrum i en dobbeltbinding (f.eks. addtion af HBr til en alkene). Dette er et typisk tilfælde af en additionsreaktion.
- Elektrofil aromatisk substitution (EAS) — et elektrofil angriber en aromatisk ring (fx nitrering med NO2+).
- Nukleofil substitution — substratet (typisk et kulstof bundet til en god leaving group) fungerer som elektrofil; i SN1 dannes først en karbokation (elektrofil), som så angribes af nukleofilen, mens SN2 er et samtidig angreb på et elektrofilisk center.
- Acylation og alkylation — elektrofile arter såsom acyliumioner eller alkyl-halider aktiveret af Lewis-syrer angriber aromatiske eller nukleofile centre.
Yderligere begreber
- Lewis-syre/baseteorien: En elektrofil betegnes ofte som en Lewis-syre, fordi den accepterer et elektronpar fra en Lewis-base (nukleofil).
- HSAB-princippet: "Hard" elektrofiler (fx H+, Mg2+) foretrækker at reagere med "hårde" nukleofiler (fx OH−), mens "bløde" elektrofiler (fx I+, Hg2+) reagerer bedre med bløde nukleofiler (fx R−, π-systemer).
- Orbital-perspektivet: Reaktiviteten styres af overlap mellem nukleofilens HOMO og elektrofilens LUMO — lille energiforskel og godt symmetrisk overlap giver hurtigere reaktion.
Praktiske anvendelser og betydning
Forståelse af hvilke arter der fungerer som elektrofiler er central i organisk syntese — mange former for funktionalisering af molekyler sker gennem kontrollerede angreb af elektrofiler (f.eks. alkylation, acylering, halogenering, nitrering). Lewis-syrer bruges ofte som katalysatorer for at øge elektrofiliciteten af et substrat og dermed fremme ønskede reaktioner.
Hvordan man genkender en elektrofil i praksis
- Se efter formel positiv ladning eller delvis positivt atom (C=O, C–X hvor X er elektronegativ).
- Overvej effekt af substituenter: elektrontrækkende grupper øger elektrofilicitet.
- Tænk på reaktionen: hvis et stof bliver angrebet af en nukleofil, er det sandsynligvis det elektrofile reaktant (se f.eks. forholdet til en nukleofil).
Samlet set er en elektrofil et elektronfattigt center, der søger elektroner — enten som en fritstående positiv art eller som et atom med en delvis positiv polarisering — og deres egenskaber og reaktivitet kan forklares både med simple ladningsbetragtninger og med moderne orbitalteori.
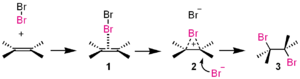
I denne additionsreaktion er brom (Br2 ) den elektrofil
Spørgsmål og svar
Q: Hvad er en elektrofil?
A: En elektrofil er et molekyle eller et atom, der er glad for at tage elektroner fra et andet.
Q: Hvorfor kaldes elektrofiler også for Lewis-syrer?
A: Elektrofile stoffer kaldes også Lewis-syrer, fordi de kan acceptere elektronpar fra andre molekyler.
Q: Hvad er nogle eksempler på elektrofile stoffer?
A: Nogle eksempler på elektrofiler er molekyler, hvor atomerne har en stor forskel i elektronegativitet, som HCl eller en carbonyl, eller også oxidationsmidler.
Q: Hvordan reagerer nukleofiler med elektrofiler?
A: Nukleofiler reagerer med elektrofiler ved at angribe dem.
Q: Hvad er en nukleofil?
A: En nukleofil er den modsatte slags molekyle af en elektrofil. Det er et molekyle eller et atom, som gerne vil donere elektroner.
Q: Hvordan opstår additionsreaktioner mellem elektrofiler og nukleofiler?
A: Additionsreaktioner opstår mellem elektrofiler og nukleofiler, når nukleofilen angriber elektrofilen og danner en ny binding.
Q: Kan en elektrofil have en negativ ladning?
A: En elektrofil kan have en positiv ladning, men den kan også have en delvis positiv ladning eller slet ingen ladning. Den vigtigste egenskab er, at den er villig til at acceptere elektroner.
Søge