Hvad er en thiol? Definition, egenskaber og anvendelser
Lær hvad en thiol er: definition, egenskaber, lugt, reaktivitet, pH-adfærd og anvendelser — fra naturgasadditiv til cystein i biologien.
Et thiol er et molekyle, der indeholder en R-SH-gruppe (et svovlatom bundet til et hydrogen og en organisk rest R). Thioler svarer til alkoholer, men i stedet for et oxygenatom er der et svovlatom. Mange små thioler har en meget karakteristisk, stærk og ofte ubehagelig lugt — derfor tilsættes thioler til naturgas, så lækager kan lugtes. Det skyldes, at metan og andre lette gaser i sig selv er lugtløse, men kan være eksplosive.
Struktur og fysiske egenskaber
Den generelle formel for en thiol er R–SH, hvor R kan være en alkyl- eller aryl-gruppe. Sammenlignet med alkoholer har thioler:
- et større svovlatom med lavere elektronegativitet end oxygen,
- et svagere S–H-bindingsstyrke end O–H, hvilket gør S–H lettere at bryde,
- mindre hydrogenbinding end tilsvarende alkoholer, hvorfor kogepunkter ofte er lavere end for alkoholer af samme molvægt,
- meget lav lugtgrænse — selv få molekyler kan give tydelig lugt (f.eks. methanethiol, CH3SH).
Syrereststyrke og nukleofilitet
Thioler er generelt mere sure end alkoholer. Typiske pKa-værdier for simple alkylthioler ligger omkring 8–11, mens alkoholer ofte har pKa >> 15. Når en base fjerner protonen fra S–H, dannes en thiolat (R–S−), som er en stærk nukleofil. Derfor kan thiolat deltage aktivt i reaktioner som nukleofil substitution, konjugationsadditioner (f.eks. Michael-additioner) og koordinering til metalioner.
Oxidation og disulfidbindinger
Thioler oxideres let; to thiolmolekyler kan koble sammen under oxidation og danne en disulfid (R–S–S–R). Disulfidbindinger er kemisk vigtige i biologiske systemer (se nedenfor). Thioler kan oxideres af milde oxidanter som I2 eller endda af ilt under passende betingelser.
Forekomst i naturen og biologisk betydning
En af de naturlige aminosyrer, cystein, har et thiol i sin struktur. I proteiner kan to cysteinresters thioler oxidere og danne en disulfid (cystin), hvilket stabiliserer proteiners tredimensionelle struktur. Thioler indgår også i biologiske antioxidanter som glutathion, og mange enzymer har aktive site-thioler, der er vigtige for katalyse og redox-regulering.
Typiske reaktioner og anvendelser
- Nukleofile reaktioner: Thiolater angriber carbonatomer i nukleofile substitutionsreaktioner.
- Disulfid-dannelse og -udveksling: vigtig i proteinfoldning og kemisk beskyttelse/aktivering af thioler.
- Thiol–ene-reaktioner: anvendt i polymerkemisk syntese og coatings (hurtige, selektive "click"-reaktioner).
- Koordinationskemi: thioler og thiolater binder stærkt til metaller og bruges som ligander i katalysatorer og materialer.
- Industrielle anvendelser: tilsætning til naturgas som lugtindikator, anvendelse i vulkanisering og som mellemprodukter i organisk syntese.
- Medicin: flere lægemidler indeholder thioler, fx captopril (en ACE-hæmmer).
Fremstilling
Almindelige syntesemetoder omfatter nukleofil substitution af alkylhalider med hydrogensulfid eller thiolation via thiouria-ruter, reduktion af disulfider og additionsreaktioner på dobbeltbindinger. Valg af metode afhænger af den ønskede thioltype og funktionalitet i molekylet.
Sikkerhed og håndtering
Thioler er ofte brandfarlige, kan være giftige i større koncentrationer og har stærke, ubehagelige lugte, som kan gøre laboratoriearbejde og industriel håndtering besværlig. God ventilation, sluttesystemer og lugtstoffer i gasser (hvor relevant) anvendes for sikkerhed. Ved arbejde i laboratorier bør man bruge passende personlig beskyttelse og opbevare thioler i forseglede beholdere.
Sammenfattende er thioler en vigtig og alsidig gruppe af organiske forbindelser med særlige kemiske egenskaber (høj nukleofilitet, let oxiderbarhed og markant lugt) og betydelige roller i både industri og biologi.
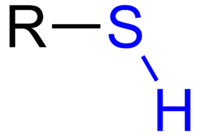
Generel formel for et thiol
Spørgsmål og svar
Q: Hvad er en thiol?
A: En thiol er et molekyle, der har en R-SH-gruppe.
Q: Hvordan minder thioler om alkoholer?
A: Thioler er ligesom alkoholer med et iltatom udskiftet med et svovlatom.
Q: Hvorfor tilsætter man thioler til naturgas?
A: Thioler tilsættes naturgas, så folk kan lugte det, fordi metan, som er lugtfrit, meget let kan eksplodere.
Q: Hvad er den stærke og dårlige lugt, der er forbundet med thioler?
A: Thioler har ofte en meget stærk og dårlig lugt.
Q: Hvad sker der, når en base fjerner en proton fra en thiol?
A: Når protonen fjernes af en base, kan thiolen blive en nukleofil.
Q: Hvilken slags syre er thioler?
A: Thioler er ret sure, mere end alkoholer.
Q: Har en af de naturlige aminosyrer en thiol i sin struktur?
A: Ja, en af de naturlige aminosyrer, cystein, har en thiol i sin struktur.
Søge