Ikke-bindende elektronpar (lone pair): Definition og betydning i kemi
Ikke-bindende elektronpar (lone pair): rolle i valenselektroner, molekylform, nukleofil reaktivitet og betydning for kemiske bindinger.
Et lone pair er et par af to fælles elektroner, som ikke indgår i en kovalent binding mellem atomer. De befinder sig i atomets yderste skal, dvs. i valensskallen, og sammen med de bindingselektroner udgør de atomets samlede antal elektroner i valenslaget. Lonepar er parrede (ikke-frie radikal-elektroner) og ligger i ikke-bindende molekylære orbitaler; disse nonbinding-orbitaler har ofte højere energi end bindingsorbitalerne.
Betydning for molekylform og geometri
Lonepar påvirker molekylers form kraftigt. Ifølge VSEPR-teorien (valence shell electron pair repulsion) optager lonepar mere plads omkring et atom end bindende elektronpar, fordi de kun er bundet til ét atom og derfor har et tættere elektronfelt. Derfor skubber lonepar bindingspar væk og reducerer bundvinkler.
- Eksempler: Vand (H2O) har to lonepar på oxygen og får en bøjet form med bindingsvinklen ≈ 104,5°; Ammoniak (NH3) har ét lonepar og en trigonal pyramidal form med vinkler ≈ 107°.
- Lonepar på samme atom fordeles, så de ligger så langt fra hinanden som muligt for at minimere frastødning.
Reaktivitet: nukleofil, base og ligand
Lonepar er ofte ansvarlige for et atoms eller en gruppes kemiske reaktivitet:
- Som nukleofil (electron-donor) kan et lonepar angribe et elektrofil og danne en ny kovalent binding — fx angriber et lonepar på nitrogen eller oxygen ofte en positivt ladet eller elektronfattig centrum.
- Som Bronsted-base kan lonepar optage en proton (H+), fordi protonen bindes direkte til loneparet.
- Lonepar fungerer som Lewis-base ved at donere et elektronpar til metaller eller andre elektrontomme centre; dermed kan molekyler med lonepar fungere som ligander i koordinationskemi.
Resonans, delokalisering og effekt på syre/baseegenskaber
Lonepar kan delokaliseres ind i π-systemer gennem resonans, hvilket ændrer deres tilgængelighed som nucleofile og deres basestyrke. Et lonepar, der er delokaliseret (fx i en amin som er bundet til en aromatisk ring eller i en carbonylforbindelse), er ofte mindre tilgængeligt til at binde protoner eller angribe elektrofile centre, hvilket gør stoffet mindre basiskt eller nukleofilt.
Hybridisering og orbitalkarakter
Lonepar kan befinde sig i orbitaler med forskellige hybridiseringskarakter (fx sp3, sp2 eller ren p), og dette påvirker både geometri og reaktivitet. I mange carbonylforbindelser er oxygenets lonepar delvist i en sp2-orbital og kan have forskellig evne til at delokalisere ind i π-systemet sammenlignet med et lonepar i en p-orbital.
Notationsregler, formel ladning og oktetreglen
I Lewis-strukturer tegnes lonepar typisk som prikker eller streger omkring atomerne. Lonepar er vigtige ved beregning af formelle ladninger: et lonepar tæller som to elektroner på det atom, hvor de hører til. For mange hovedgruppens elementer gælder oktetreglen (otte elektroner i valensskallen), men elementer i 3. periode og derover kan have udvidede oktetter og flere lonepar eller bindingspar end otte.
Fysiske egenskaber og andre konsekvenser
- Lonepar på oxygen og nitrogen styrker muligheden for hydrogenbinding, hvilket øger kogepunkter og opløselighed i vand for mange forbindelser.
- Lonepar påvirker molekylers dipolmoment og dermed polaritet.
- I spektroskopi (IR, NMR) kan tilstedeværelsen og miljøet omkring lonepar påvirke signalernes position og intensitet.
Praktiske eksempler
- Oxygen i H2O har to lonepar; begge bidrager til vandets hydrogenbindingsnetværk og til dens bøjede geometri.
- Ammoniak (NH3) har ét lonepar, som gør molekylet basiske og i stand til at binde sig til protoner eller metalcentre.
- Halidioner (F–, Cl–) består i praksis af lonepar (parrede elektroner) og er stærke nukleofiler og baser afhængigt af miljøet.
- I karbonylforbindelser (C=O) har oxygen to lonepar, hvoraf ét ofte delokaliseres i resonans og påvirker reaktiviteten mod nukleofile angreb på carbonet.
Sammenfattende er lonepar centrale for forståelsen af molekylers geometri, reaktivitet og fysiske egenskaber. De fungerer både som elektronreservoirer ved dannelse af nye bindinger og som strukturelle faktorer, der bestemmer vinkler og interaktioner mellem molekyler.
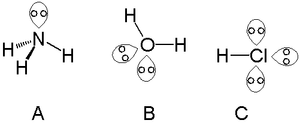
Lonepar i ammoniak (A), vand (B) og saltsyre (C)
Søge