Sulfoxid – definition, struktur, egenskaber og anvendelser (DMSO)
Læs om sulfoxid (DMSO): struktur, chiralitet, kemiske egenskaber og praktiske anvendelser som opløsningsmiddel og ligand i organisk kemi og biokemi.
Et sulfoxid er et molekyle, hvor et svovlatom er bundet til to kulstof-atomer og ét oxygenatom. Sulfoxider dannes ved oxidering af thioethere (sulfider) uden at gå hele vejen til sulfonen, altså i et mellemliggende oxideringsstadium. Mange svovlholdige forbindelser har karakteristiske lugte, og enkelte sulfoxider kan derfor også lugte stærkt.
Struktur og stereokemi
Sulfoxider kan skrives med den generelle formel R-S(=O)-R'. Svovl danner en formelt dobbeltbundet interaktion med oxygenet og enkeltbindinger til de to kulstofsubstituenter, samtidig med at der er et elektronpar (lone pair) på svovlatomet. Geometrien omkring svovlatomet er tilnærmelsesvis tetraedrisk, og fordi de to substituenter ofte er forskellige, kan svovlatomet fungere som et chiralt center. Det betyder, at mange sulfoxider kan eksistere som enantiomerer, som i nogle tilfælde kan isoleres og anvendes i asymmetrisk syntese.
Elektronisk egenskaber og koordinationskem i
Sulfoxider er polære: S=O-gruppen er stærkt dipolær og gør sulfoxider gode polare, aprotiske opløsningsmidler i organisk kemi. Samtidig er sulfoxider gode ligander for overgangsmetaller. Koordination sker typisk via oxygenet (O-bindning), men under særlige forhold kan også svovlkoordinering forekomme. Denne fleksibilitet gør sulfoxider nyttige i komplekskemi og katalyse.
Syntese og kemisk reaktivitet
Den mest direkte vej til sulfoxider er selektiv oxidering af tilsvarende thioethere med et passende oxidationsmiddel (fx peroxider eller uorganiske oxidationsmidler) i kontrollerede mængder, så man undgår overoxidering til sulfoner. Sulfoxider kan desuden reduceres tilbage til sulfider eller videreoxideres til sulfones. Der findes også specifikke omlejrings- og substitutionsreaktioner, hvor sulfoxider indgår (fx Pummerer-omlejring under passende betingelser), hvilket gør dem nyttige som byggesten i organisk syntese.
Dimethylsulfoxid (DMSO)
Et vigtigt og velkendt eksempel på denne stofklasse er dimethylsulfoxid, ofte forkortet DMSO. DMSO har formel (CH3)2S=O og er kendt som et kraftigt opløsningsmiddel. Det er polært og aprotisk, blander sig godt med vand og opløser mange organiske og uorganiske stoffer. DMSO anvendes bredt i laboratorier og industrien, især inden for biokemi og medicinalkemi — for eksempel i Swern-oxidationer, som reaktionsmedium ved biologiske forsøg og som kryobeskyttelsesmiddel i cellekulturer ved nedfrysning (typisk i kombination med andre additiver).
Anvendelser
- Som opløsningsmiddel i organisk syntese og i biokemiske forsøg.
- Som ligand i overgangsmetalkomplekser og i katalytiske processer.
- I industrielle processer, hvor polære, ikke-protiske opløsningsmidler er nødvendige.
- Særlige sulfoxider anvendes også som byggesten i lægemiddeldesign og i asymmetrisk syntese (pga. deres chirale svovlcenter).
Sikkerhed og håndtering
DMSO og andre sulfoxider har generelt lav flygtighed sammenlignet med mange organiske opløsningsmidler, men DMSO trænger let igennem huden og kan transportere opløste stoffer ind i kroppen. Derfor bør man altid bruge passende beskyttelse (handsker, briller) og undgå hudkontakt. Som ved alle reagenser er korrekt affaldshåndtering og kendskab til stoffets sikkerhedsdatablad vigtig.
Samlet set er sulfoxider en alsidig og kemisk interessant stofgruppe: de kombinerer polaritet og koordinerende evne med mulighed for stereokontrol, hvilket gør dem værdifulde både som opløsningsmidler, reagenser og ligander i moderne kemi.
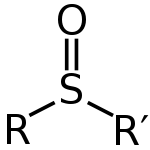
Generel struktur af et sulfoxid
Spørgsmål og svar
Q: Hvad er en sulfoxid?
A: En sulfoxid er et molekyle, der har et svovlatom bundet til to kulstofatomer og et oxygenatom.
Q: Hvor kommer sulfoxid fra?
A: Sulfoxid kommer fra oxidering af thioethere uden at gå hele vejen til sulfonen.
Q: Hvad er den generelle formel for sulfoxider?
A: Den generelle formel for sulfoxider er R-S(=O)-R'.
Q: Hvad er formen på atomet i sulfoxider?
A: Formen på atomet i sulfoxider er tetraedrisk.
Q: Kan svovl være et chiralt center i sulfoxider?
A: Ja, svovl i sulfoxider kan være et chiralt center.
Q: Hvad er dimethylsulfoxid, og hvad bruger man det til?
A: Dimethylsulfoxid, også kendt som DMSO, er et vigtigt sulfoxidmolekyle og bruges som opløsningsmiddel til mange reaktioner, især inden for biokemi.
Q: Hvorfor bruges sulfoxider som gode ligander for overgangsmetaller?
A: Sulfoxider bruges som gode ligander for overgangsmetaller på grund af deres evne til at koordinere med metalioner på grund af elektronparret på svovlatomet.
Søge