Overgangstilstand i kemi: Definition, aktiveringsenergi og betydning
Forstå overgangstilstand i kemi: definition, aktiveringsenergi, reaktionsmekanismer, betydning for hastighed og metoder til beregning og analyse.
I en kemisk reaktion er overgangstilstanden det punkt, hvor der er en maksimal energiværdi. Denne energi kaldes aktiveringsenergien. Når to eller flere molekyler blandes, vil de støde på hinanden. Hvis de rammer hinanden med tilstrækkelig energi til at gå gennem overgangstilstanden, vil de reagere og danne nye molekyler. I overgangstilstanden dannes der nye bindinger, mens de gamle bindinger brydes. I en graf eller tegning er overgangstilstanden ofte markeret med dobbeltdolket ‡-symbolet.
Det er meget vanskeligt at undersøge en overgangstilstand. Det skyldes, at den har en så høj energi, at molekylerne forbliver i denne form i meget kort tid, normalt femtosekunder. Det er vigtigt ikke at forveksle overgangstilstande med intermediære tilstande. Intermediater findes ved minimumspunkter af energi, og de kan leve i meget lang tid. Ligesom en overgangstilstand befinder et mellemprodukt sig imidlertid mellem reagenser og produkter i en reaktion.
Undersøgelse af overgangstilstande er meget vigtig for at forstå reaktionsmekanismer. Der findes teorier og computerprogrammer, der kan bruges til at beregne, hvordan overgangstilstanden ser ud. Dette er en del af den kemiske kinetik.
Hvad er en overgangstilstand teknisk set?
Overgangstilstanden er et punkt på potentialeenergiydefladen (potential energy surface, PES) svarende til et energimaksimum langs reaktionsvejen mellem reaktanter og produkter. Den beskriver en geometrisk konfiguration af atomare positioner, hvor den reaktive koordinat har et maksimum, mens alle andre koordinater viser et minimum i denne retning — derfor kaldes den ofte en førsteordens sadelpunkt.
Aktiveringsenergi og reaktionshastighed
Aktiveringsenergien er den energibarriere, reaktanterne skal overkomme for at nå overgangstilstanden. Størrelsen af denne barriere bestemmer i høj grad reaktionshastigheden: jo højere barriere, desto langsommere reaktion ved en given temperatur. Dette beskrives kvantitativt i Arrhenius-ligningen, og mere detaljeret af Eyring-teorien, som også skelner mellem bidrag fra aktiveringsentalpi og aktiveringsentropi.
Forskellen mellem overgangstilstand og intermediater
- Overgangstilstand: et energimaksimum på reaktionskoordinaten, kun stabilt i ekstremt kort tid (virtuelt, ikke isolerbart).
- Intermediat: et energiminimum mellem to trin i en flertrinsreaktion; kan ofte isoleres eller påvises direkte.
Hvordan studerer man overgangstilstande?
- Eksperimentelt: kinetiske målinger (hastighedskonstanter, temperaturafhængighed), isotop-effekter (primære og sekundære kinetiske isotop-effekter), hurtig spektroskopi og kryoprotektion kan give indirekte information om overgangstilstandens natur.
- Teoretisk og computermæssigt: kvantekemiske beregninger (f.eks. DFT, ab initio) bruges til at lokalisere sadelpunkter på PES, beregne aktiveringsenergier og forudsige geometrier og elektronfordelinger i overgangstilstanden. Metoder som nudged elastic band (NEB) eller intrinsic reaction coordinate (IRC) hjælper med at følge reaktionsvejen.
Betydning for katalyse og mekanismer
Katalysatorer virker ved at ændre reaktionsvejen, typisk ved at sænke aktiveringsenergien og dermed gøre overgangstilstanden lavere i energi. Det øger antallet af molekyler, som har tilstrækkelig energi til at nå overgangstilstanden ved en given temperatur, og øger dermed reaktionshastigheden uden at ændre det termodynamiske resultat (produkter).
Praktiske eksempler og nyttige principper
- SN2-reaktion: har en enkelt, konsolideret overgangstilstand hvor et nukleofil angriber samtidig med at afgangsgruppen forlader. Denne overgangstilstand er typisk trigonal bipyramidal-lignende for carbon.
- SN1-reaktion: går gennem et karbokation-intermediat; her er overgangstilstanden til dannelsen af karbokationen afgørende for hastighedsbestemmelsen.
- Hammond-postulatet: siger, at overgangstilstandens struktur ligner enten reaktanter eller produkter afhængigt af om reaktionen er eksoterm eller endoterm — et hjælpsomt heuristisk værktøj til at forudsige TS-karakter.
Opsummering
Overgangstilstanden er det højeste energipunkt langs en reaktionsvej og afgør, hvor hurtigt en given kemisk proces forløber. Selvom overgangstilstande ikke kan isoleres, kan deres egenskaber indirekte bestemmes gennem kinetik, isotopstudier, spektroskopi og avancerede beregningsmetoder. Forståelsen af overgangstilstande er central for at designe effektive katalysatorer og for at få indsigt i reaktionsmekanismer.
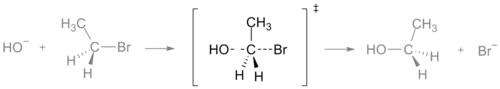
Overgangstilstanden i en SN2-reaktion
Spørgsmål og svar
Q: Hvad er overgangstilstanden i en kemisk reaktion?
A: Overgangstilstanden er det punkt, hvor der er en maksimal værdi af energi i en kemisk reaktion.
Q: Hvad er aktiveringsenergien i en kemisk reaktion?
A: Den energi, der kræves, for at en reaktion kan finde sted, kaldes aktiveringsenergien.
Q: Hvad sker der, når to eller flere molekyler blandes i en kemisk reaktion?
A: Når to eller flere molekyler blandes, vil de ramme hinanden. Hvis de rammer hinanden med nok energi til at gå gennem overgangstilstanden, vil de reagere og danne nye molekyler.
Q: Hvad bruges symbolet med den dobbelte dolk (‡) til i en graf eller tegning af en kemisk reaktion?
A: Symbolet med den dobbelte dolk (‡) bruges til at markere overgangstilstanden i en graf eller tegning af en kemisk reaktion.
Q: Hvorfor er det svært at studere overgangstilstanden i en kemisk reaktion?
A: Det er meget vanskeligt at studere overgangstilstanden i en kemisk reaktion, fordi den har så høj energi, at molekylerne kun vil forblive i den form i meget kort tid, normalt femtosekunder.
Q: Hvad er et mellemprodukt i en kemisk reaktion?
A: Et mellemprodukt er et molekyle, der findes ved et minimum af energi i en kemisk reaktion, og som kan leve i meget lang tid.
Q: Hvorfor er det vigtigt at studere overgangstilstande for at forstå reaktionsmekanismer?
A: At studere overgangstilstande er vigtigt for at forstå reaktionsmekanismer, fordi det hjælper med at bestemme, hvordan en reaktion opstår, og hvordan man kontrollerer eller manipulerer den.
Søge