Cheletropiske reaktioner: Definition, mekanisme og eksempler
Cheletropiske reaktioner: klar definition, mekanisme og illustrative eksempler — lær cheletropiske ekstruderinger, bindingsomlægning og reaktionsdrivere.
En cheletropisk reaktion er en særlig type pericyklisk reaktion, hvor et atom på en af reagenserne danner to nye bindinger samtidig til samme atom i den anden reaktant. Pericykliske reaktioner involverer en overgangstilstand med en cyklisk række af atomer og en tilhørende cyklisk række af interagerende orbitaler; der sker en samtidig reorganisering af σ- og π-bindinger i denne cykliske række, og cheletropiske reaktioner følger samme grundprincip.
Mekanisme og orbitalsymmetri
Cheletropiske reaktioner foregår ofte concerted (dvs. i én trinvis bevægelse uden isolerbare radikal- eller ionintermediater) gennem en cyklisk overgangstilstand. Woodward–Hoffmann-reglerne for orbitalsymmetri gælder: hvordan de involverede orbitaler overlapper (suprafacielt vs. antarfacielt) bestemmer, om en given vej er symmetry-allowed under termiske eller fotokemiske forhold. Et klassisk eksempel er addition af en singulet carbene til en dobbeltbinding (alken) — her kan begge nye σ-bindinger dannes synkront til samme carbons center og reaktionen er symmetri-allowed og stereospecifik.
Det er dog vigtigt at bemærke, at mekanismen kan variere afhængigt af reagensernes elektroniske tilstande. Hvis et reaktivt mellemprodukt er i en triplettilstand (f.eks. en tripletcarben), kan reaktionen forløbe via stepwise radikal-trin i stedet for en fuldstændig concerted cheletropisk vej.
Karakteristiske træk
- To nye bindinger til ét atom: Det definerende træk ved en cheletropisk reaktion er, at begge nye bindinger på den ene reaktant ender på samme atom i den anden reaktant.
- Stereospecificitet: Mange cheletropiske additioner er stereospecifikke — for eksempel bevares cis/trans-konfigurationen af en dobbeltbinding ved addition af en singulet carbene (giver forholdsmæssigt cis-cyclopropaner fra cis-alkener).
- Termodynamik: Nogle cheletropiske ekstruderinger (omvendte cheletropiske reaktioner) frigiver små, stabile molekyler som CO eller N2. Drivkraften for disse reaktioner kan ofte være den entropiske fordel ved at frigive en gas (f.eks. CO eller N2), hvilket øger fri energi for processen.
Eksempler
- Carbene-additioner til alken: Addition af :CR2 (carbener) til C=C for at danne cyclopropaner er et klassisk cheletropisk eksempel. Reaktionen kan være termisk eller katalyseret (f.eks. overgangsmetalkomplekser, diazoforløbere) og er typisk stereospecifik.
- Sulfolen-dannelse: Addition af SO2 til konjugerede diener kan føre til dannelse af sulfolener (et femleddet ringsystem med sulfonylgruppe). Den omvendte proces — cheletropisk extrusion af SO2 fra sulfolener — bruges syntetisk til at lagre og frigive SO2 under kontrollerede forhold.
- Decarbonylisering/ekstrudering af CO: Visse cykliske carbonylforbindelser kan ved opvarmning eller fotolyse udskille CO gennem en cheletropisk ekstrudering; et eksempel er termisk eller fotokemisk afgivelse af carbonmonoxid fra passende ringstrukturer, hvor carbonylcarbonet ender som CO. Slutresultatet er to nye bindinger til ét atom i den tilbageblevne struktur.
Stereokemi, kinetik og undtagelser
Fordelen ved cheletropiske reaktioner i syntese er ofte høj stereokontrol og mildere betingelser for nogle systemer. Kinetisk afhænger reaktionshastigheden af naturen af den elektrofile eller nukleofile partner, eventuelle katalysatorer (f.eks. Rh-, Cu- eller Zn-baserede karbenekatalysatorer), og om reaktionen går via singlet- eller triplet-tilstande. I tilfælde hvor stepwise radikale eller ioniske mellemtrin indtræder, kan stereospecificiteten gå tabt.
Anvendelser og praktiske overvejelser
- Syntetisk værdi: Cyclopropanering ved cheletropiske karbene-additioner er en almindelig metode i opbygningen af treledede ringe, som findes i mange naturlige produkter og lægemidler.
- Beskyttelse og transport af små gasser: Sulfolener bruges som stabile "bærere" af SO2; tilsvarende kan nogle cheletropiske ekstruderinger benyttes til at generere CO eller N2 in situ, men dette kræver omhyggelig håndtering pga. toksicitet (især CO).
- Sikkerhed: Da nogle cheletropiske processer frigiver giftige eller brændbare gasser (f.eks. carbonmonoxid), skal eksperimenter planlægges med korrekt ventilation og sikkerhedsforanstaltninger.
Resumé: Cheletropiske reaktioner er en informativ og nyttig underklasse af cycloadditioner, kendetegnet ved, at to nye bindinger dannes til samme atom i én concerted hændelse. Forståelse af orbitalsymmetri, elektronisk tilstand og reaktionsbetingelser er afgørende for at forudsige, om en given cheletropisk vej er tilladt og hvilken stereokemisk outcome man kan forvente.

Figur 1. Pericykliske reaktioner
Teoretisk analyse
På grund af geometrien af de molekyler, der er involveret i cheletropiske reaktioner, bekræfter de en række forudsigelser fra teoretiske kemikere. Cheletropiske reaktioner bekræfter bevarelsen af molekylær orbital symmetri.
I den pericykliske overgangstilstand afgiver et lille molekyle to elektroner til ringen. Der er to mulige geometrier, der kan forklare reaktionen. Det lille molekyle kan nærme sig enten lineært eller ikke-lineært. I den lineære tilgang er elektronerne i det lille molekyls orbital rettet direkte mod π-systemet i det store molekyle. I den ikke-lineære tilgang nærmer orbitalen sig i en lidt skæv vinkel. π-systemets evne til at rotere, når det lille molekyle nærmer sig, er afgørende for dannelsen af nye bindinger. Rotationsretningen vil være forskellig, afhængigt af hvor mange π-elektroner der er i systemet. Nedenfor er vist et diagram af et fragment med to elektroner, der nærmer sig et π-system med fire elektroner ved hjælp af grænsemolekylære orbitaler. Rotationen vil være disrotatorisk, hvis det lille molekyle nærmer sig lineært, og konrotatorisk, hvis molekylet nærmer sig ikke-lineært. Disrotatorisk og konrotatorisk fortæller, hvordan bindingerne i π-systemet roterer. Disrotatorisk betyder modsatrettede, mens konrotatorisk betyder samme retning. Dette er også vist i nedenstående diagram.
Ved hjælp af Huckels regel kan man se, om π-systemet er aromatisk eller antiaromatisk. Hvis det er aromatisk, anvender lineære metoder en disrotatorisk bevægelse, mens ikke-lineære metoder anvender en konrotatorisk bevægelse. Det modsatte gælder for et antiaromatisk system. Ved lineære metoder vil man anvende konrotatorisk bevægelse, mens ikke-lineære metoder vil anvende disrotatorisk bevægelse.
Cheletropiske reaktioner med SO2
Termodynamik
Når svovldioxid reagerer med butadien og isopren, opstår der to forskellige produkter. Reaktionsmekanismen bestemmer, hvad der bliver dannet. Et kinetisk produkt og et termodynamisk produkt er begge mulige. Der dannes mere af det termodynamiske produkt end af det kinetiske produkt. Det kinetiske produkt kommer fra en Diels-Alder-reaktion, mens en cheletropisk reaktion giver et mere termodynamisk stabilt produkt. Den cheletropiske reaktion anvendes mere, fordi den giver et mere stabilt femleddet ringaddukt. Skemaet nedenfor viser forskellen mellem de to produkter. Vejen til venstre viser det termodynamiske produkt, mens vejen til højre viser det kinetiske produkt. Suarez og Sordo viste dette i 1995. De viste det både med eksperimenter og ved hjælp af Gauss-beregninger.
Kinetik
Et eksempel herpå er de cheletrope reaktioner af 1,3-diener med svovldioxid. Kemikere har nøje undersøgt kinetikken for denne reaktion. I 1976 målte Isaacs og Laila de kenetiske faktorer for addition af svovldioxid til butadienderivater. Additionshastigheden blev overvåget i benzen ved 30 °C med et indledende tyve gange større overskud af dien. De brugte et spektrofotometer til at undersøge lys ved 320 nm for at måle SO2 . Reaktionen viste en "pseudo første-ordenskinetik". Kemikerne fandt ud af, at elektronhævdende grupper på dienet nedsatte reaktionshastigheden. Reaktionshastigheden blev også i høj grad påvirket af steriske virkninger af 2-substituenter, idet mere voluminøse grupper øgede reaktionshastigheden. (Med andre ord, jo større gruppe af atomer, der hang fra det andet kulstofatom, jo hurtigere gik reaktionen). Forfatterne tilskriver dette den tendens, som voluminøse grupper har til at begunstige dienens cisoide konformation, som er afgørende for reaktionen (se tabellen nedenfor). Desuden blev hastighederne ved fire temperaturer målt for syv af dienerne. Ud fra disse målinger brugte kemikerne Arrhenius-ligningen til at beregne aktiveringsenthalpien (ΔH‡ ) og aktiveringsentropien (ΔS‡ ) for hver reaktion. Dette var et af de første vigtige forsøg på at studere kenetikken af en cheletropisk reaktion.
| -Butadien | 104 k /min−1 (30 °C) (± 1-2%) absolut | 104 k /min−1 (30 °C) (± 1-2%) relativ | ΔH‡ /kcal mol−1 | ΔS‡ /cal mol−1 K−1 |
| 2-methyl | 1.83 | 1.00 | 14.9 | -15 |
| 2-ethyl | 4.76 | 2.60 | 10.6 | -20 |
| 2-isopropyl | 13.0 | 7.38 | 12.5 | -17 |
| 2-tert-butyl | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentyl | 17.2 | 9.4 | 11.6 | -18 |
| 2-kloro | 0.24 | 0.13 | N/A | N/A |
| 2-bromoethyl | 0.72 | 0.39 | N/A | N/A |
| 2-p-tolyl | 24.7 | 13.5 | 10.4 | -19 |
| 2-phenyl | 17.3 | 9.45 | N/A | N/A |
| 2-(p-bromophenyl) | 9.07 | 4.96 | N/A | N/A |
| 2,3-dimethyl | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-methyl | 0.18 | 0.10 | N/A | N/A |
| trans-1-methyl | 0.69 | 0.38 | N/A | N/A |
| 1,2-dimethylen-cyclohexan | 24.7 | 13.5 | 11.4 | -16 |
| 2-methyl-1,1,4,4,4-d4 | 1.96 | N/A | N/A | N/A |
Monnat, Vogel og Sordo målte i 2002 kinetikken for addition af svovldioxid til 1,2-dimethylidenecycloalkaner. De skrev, at reaktionen af 1,2-dimethylidenecyclohexan med svovldioxid kan give to forskellige produkter afhængigt af reaktionsbetingelserne. Reaktionen giver det tilsvarende sultin gennem en hetero-Diels-Alder-reaktion under kinetisk kontrol (≤ -60 °C), men under termodynamisk kontrol (≥ -40 °C) giver reaktionen det tilsvarende sulfolen gennem en cheletropisk reaktion. Aktiveringsenthalpien for hetero-Diels-Alder-reaktionen er ca. 2 kcal/mol mindre end for den tilsvarende cheletropiske reaktion. Sulfolenet er ca. 10 kcal/mol mere stabilt end det isometriske sultin i CH2 Cl /SO22 opløsning.
Forfatterne var i stand til eksperimentelt at udarbejde en hastighedslov ved 261,2 K for reaktionen af 1,2-dimethylidencyclohexan med svovldioxid for at give den tilsvarende sulfolen. Reaktionen var af første orden i 1,2-dimethylidencyclohexan, men af anden orden i svovldioxid (se nedenfor). Dette bekræftede en forudsigelse fra teoretiske kemikere baseret på ab initio-kvanteberegninger på højt niveau. Ved hjælp af beregningsmetoder foreslog forfatterne en overgangsstruktur for den cheletrope reaktion af 1,2-dimethylidencyclohexan med svovldioxid (se figuren til højre). Reaktionen er af anden orden i svovldioxid, fordi et andet svovldioxidmolekyle sandsynligvis binder sig til overgangstilstanden for at hjælpe med at stabilisere den. Lignende resultater blev fundet i en undersøgelse fra 1995 af Suarez, Sordo og Sordo, som brugte ab initio-beregninger til at studere den kinetiske og termodynamiske kontrol af svovldioxidreaktionen med 1,3-diener.
Virkninger af opløsningsmidler
Effekten af opløsningsmidlet i den cheletropiske reaktion af 3,4-dimethyl-2,5-dihydrothiophen-1,1-dioxid (vist til højre) blev kinetisk undersøgt i 14 opløsningsmidler. Reaktionshastighedskonstanterne for den fremadrettede og den omvendte reaktion samt ligevægtskonstanterne viste sig at være lineært korreleret med ET (30) polarisationsskalaen for opløsningsmidler.
Reaktionerne blev udført ved 120 °C og blev undersøgt ved 1H-NMR-spektroskopi af reaktionsblandingen. Det blev konstateret, at den fremadrettede hastighed k1 faldt med en faktor 4,5 fra cyclohexan til methanol. Den omvendte hastighed k-1 blev fundet at stige med en faktor 53 fra cyclohexan til methanol, mens ligevægtskonstanten Keq faldt med en faktor 140. Det tyder på, at der sker en ændring af polariteten under aktiveringsprocessen, hvilket fremgår af forholdet mellem ligevægts- og kinetiske data. Forfatterne siger, at reaktionen synes at være påvirket af opløsningsmidlets polaritet, og at dette kan påvises ved ændringen i dipolmomenterne, når man går fra reaktant til overgangstilstand til produkt. Forfatterne anfører også, at den cheletrope reaktion ikke synes at blive påvirket af hverken opløsningsmidlets surhed eller basiskhed.
Resultaterne af denne undersøgelse får forfatterne til at forvente følgende adfærd:
1. Ændringen i opløsningsmidlets polaritet vil påvirke hastigheden mindre end ligevægten.
2. Hastighedskonstanterne vil være kendetegnet ved modsatrettet virkning på polariteten: k1 vil falde en smule med stigningen af ET (30), og k-1 vil stige under de samme betingelser.
3. Virkningen på k-1 vil være større end på k1 .
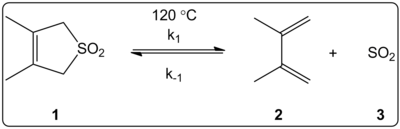
Cheletropisk reaktion undersøgt i forskellige opløsningsmidler

Foreslået overgangstilstand for reaktion af 1,2-dimethylidencyclohexan med SO2 for at give en sulfolen gennem en cheletropisk reaktion

Reaktion af 1,2-dimethylidencyclohexan med SO2 giver en sultin gennem en heterodiels-Alder-reaktion under kinetisk kontrol eller en sulfolen gennem en keletropisk reaktion under termodynamisk kontrol
Carbentilsætninger til alkener
En af de syntetisk vigtigste cheletropiske reaktioner er additionen af et singlet carbene til en alken for at fremstille et cyclopropan (se figuren til venstre). Et carbene er et neutralt molekyle, der indeholder et tosidigt kulstof med seks elektroner i sin valensskal. På grund af dette er carbener meget reaktive elektrofiler og dannes som mellemprodukter i reaktionen. Et singlet carbene indeholder en tom p-orbital og en ca. sp2 hybridorbital, der har to elektroner. Singlet carbener adderer stereospecifikt til alkener, og alkenstereokemien bevares i cyclopropanproduktet. Mekanismen for addition af et carbene til et alken er en samordnet [2+1] cycloaddition (se figuren). Carbener fra chloroform eller bromoform kan anvendes til at tilføje CX2 til et alken for at give et dihalocyclopropan, mens Simmons-Smith-reagenset tilføjer CH2 .
Interaktion mellem den fyldte carbene-orbital og alkenens π-system skaber et system med fire elektroner og fremmer en ikke-lineær tilgang. Det er også gunstigt at blande carbenets tomme p-orbital med det fyldte alken π-orbital. En gunstig blanding sker ved en ikke-lineær fremgangsmåde (se figur 2 til højre). Selv om teorien klart favoriserer en ikke-lineær tilgang, er der imidlertid ingen åbenlyse eksperimentelle konsekvenser for en lineær vs. ikke-lineær tilgang.

Figur 2. A) Orbitaler for singletcarbener B) Ikke-lineær tilgang til a) Carbene sp2 Orbital og b) Carbene p Orbital

Addition af et carbene til en alken for at danne en cyklopropan
Spørgsmål og svar
Q: Hvad er en cheletropisk reaktion?
A: En cheletropisk reaktion er en type pericyklisk reaktion, hvor et atom på en af reagenserne får to nye bindinger.
Sp: Hvad er en pericyklisk reaktion?
Svar: En pericyklisk reaktion er en reaktion, der involverer en overgangstilstand med en cyklisk række af atomer og en tilhørende cyklisk række af interagerende orbitaler, hvor der sker en reorganisering af َ- og ً-bindinger.
Sp: Hvordan adskiller den sig fra andre typer reaktioner?
Svar: Cheletropiske reaktioner er en underklasse af cycloadditioner, og det, der adskiller dem fra andre typer af reaktioner, er, at der på en af reagenserne laves begge nye bindinger til det samme atom.
Spørgsmål: Hvad er nogle eksempler?
A: Eksemplerne omfatter "cheletropiske ekstruktioner" som f.eks. når det enkelte atom i carbonylgruppen ender i kulilte.
Spørgsmål: Hvad driver disse reaktioner?
A: Drivkraften for disse reaktioner er ofte den entropiske fordel ved at frigive en gas (f.eks. CO eller N2).
Spørgsmål: Er figur 1 relateret til cheletropiske reaktioner? A: Ja, figur 1 viser eksempler på cheletropiske reaktioner.
Søge
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)