Aromatisk kulbrinte
Et aromatisk kulbrinte eller aren er en kulbrinteforbindelse med en ringformet kulbrinte. Den har skiftevis dobbelt- og enkeltbindinger mellem kulstofatomer, der danner ringe. Mange af forbindelserne har en sødlig duft, deraf betegnelsen "aromatisk". Ringen af seks kulstofatomer i aromatiske forbindelser kaldes en benzenring, efter den enkleste mulige kulbrinte ring, benzen. Aromatiske carbonhydrider kan være monocykliske (MAH) eller polycykliske (PAH).
Nogle ikke-benzenbaserede forbindelser, kaldet heteroarener, som følger Hückels regel, er også aromatiske forbindelser. I disse forbindelser er mindst ét kulstofatom erstattet af et af oxygen, nitrogen eller svovl.
Benzen ringmodel
Benzen, C6 H6 , er det enkleste aromatiske carbonhydrid og blev anerkendt som det første aromatiske carbonhydrid, idet Kekulé først erkendte arten af dets binding i det 19. århundrede. Hvert kulstofatom i den sekskantede cyklus har fire elektroner til deling. En går til hydrogenatomet og en til hver af de to nabokulstofatomer. Dermed er der én til at dele med et af de to nabokulstofatomer, hvilket er grunden til, at benzenmolekylet er tegnet med vekslende enkelt- og dobbeltbindinger rundt om sekskanten.
Strukturen er også illustreret som en cirkel rundt om indersiden af ringen for at vise seks elektroner, der flyder rundt i delokaliserede molekylære orbitaler på størrelse med selve ringen. Dette repræsenterer også den ækvivalente karakter af de seks kulstof-kulstof-bindinger, der hver svarer til ~1,5. Elektronerne visualiseres som svævende over og under ringen, og de elektromagnetiske felter, de genererer, virker for at holde ringen flad.
Generelle egenskaber:
- Viser aromaticitet.
- Forholdet mellem kulstof og brint er højt.
- De brænder med en sodgul flamme på grund af det høje kulstof/hydrogen-forhold.
- De gennemgår substitutionsreaktioner.
Cirkelsymbolet for aromaticitet blev introduceret af Sir Robert Robinson og hans elev James Armit i 1925 og populariseret fra 1959 af Morrison & Boyds lærebog i organisk kemi. Den korrekte anvendelse af symbolet er omdiskuteret; i nogle publikationer bruges det til at beskrive ethvert cyklisk pi-system, i andre kun til at beskrive de pi-systemer, der følger Hückels regel.
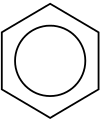
Benzen
Aren-syntese
En reaktion, der danner en arenforbindelse fra en umættet eller delvist umættet cyklisk forløber, kaldes ganske enkelt en aromatisering. Der findes mange laboratoriemetoder til organisk syntese af arener fra ikke-arene prækursorer.
Betydningen af aromatiske forbindelser
Aromatiske forbindelser spiller en central rolle i biokemien i alle levende væsener. De fire aromatiske aminosyrer histidin, phenylalanin, tryptofan og tyrosin er hver især en af de 20 grundlæggende byggesten i proteiner. Desuden er alle fem nukleotider (adenin, thymin, cytosin, guanin og uracil), som udgør sekvensen i den genetiske kode i DNA og RNA, aromatiske puriner eller pyrimidiner. Desuden indeholder molekylet hæm et aromatisk system med 22 π-elektroner. Klorofyl har også et lignende aromatisk system.
Aromatiske forbindelser er vigtige i industrien. De vigtigste aromatiske carbonhydrider af kommerciel interesse er benzen, toluen, ortho-xylen og para-xylen. Der produceres ca. 35 mio. tons på verdensplan hvert år. De udvindes af komplekse blandinger, der fremkommer ved raffinering af olie eller destillation af stenkulstjære. De anvendes til at fremstille en række vigtige kemikalier og polymerer, herunder styren, phenol, anilin, polyester og nylon.
Typer af aromatiske forbindelser
Næsten alle aromatiske forbindelser er forbindelser af kulstof, men de behøver ikke nødvendigvis at være kulbrinter.
Heterocykliske stoffer
I heterocykliske aromater er et eller flere af atomerne i den aromatiske ring af et andet grundstof end kulstof. Som eksempler kan nævnes pyridin, pyrazin, imidazol, pyrazol, oxazol og thiophen.
Polycykliske stoffer
Polycykliske aromatiske kulbrinter er molekyler med to eller flere simple aromatiske ringe, der er fusioneret sammen ved at dele to nærliggende kulstofatomer. Som eksempler kan nævnes naftalen, antracen og phenanthren.
Substituerede aromater
Mange kemiske forbindelser er aromatiske ringe med andre ting tilknyttet. Eksempler herpå er trinitrotoluen (TNT), acetylsalicylsyre (aspirin), paracetamol og DNA-nukleotiderne.
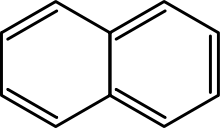
Nathlalene har to ringe.
Spørgsmål og svar
Q: Hvad er en aromatisk kulbrinte?
A: En aromatisk kulbrinte er en kulbrinteringforbindelse med skiftende dobbelt- og enkeltbindinger mellem kulstofatomer, der danner ringe, og mange af disse forbindelser har en sød duft.
Q: Hvad hedder ringen af seks kulstofatomer i aromatiske forbindelser?
A: Navnet på ringen med seks kulstofatomer i aromatiske forbindelser er en benzenring.
Q: Hvad er forskellen på monocykliske (MAH) og polycykliske (PAH) aromatiske kulbrinter?
A: Monocykliske aromatiske kulbrinter (MAH) har en enkelt ring af kulstofatomer i deres struktur, mens polycykliske aromatiske kulbrinter (PAH) har to eller flere forbundne ringe af kulstofatomer i deres struktur.
Q: Hvorfor kaldes aromatiske kulbrinter for "aromatiske"?
A: Aromatiske kulbrinter kaldes "aromatiske", fordi mange af dem har en sød duft.
Q: Hvad er heteroarener, og hvordan adskiller de sig fra benzenbaserede aromatiske forbindelser?
A: Heteroarener er ikke-benzenbaserede forbindelser, der følger Hückels regel, og som også er aromatiske forbindelser. I disse forbindelser er mindst ét kulstofatom erstattet af et af oxygen, nitrogen eller svovl.
Q: Hvad er den simplest mulige kulbrintering?
A: Den simplest mulige kulbrintering er benzen.
Q: Hvad er de to typer aromatiske kulbrinter?
A: De to typer af aromatiske kulbrinter er monocykliske (MAH) og polycykliske (PAH) aromatiske kulbrinter.
Søge