Atomteori: Historie, struktur og moderne forståelse af atomet
Atomteori: fra Demokrit til kvarker — udforsk atomets historie, struktur og moderne forståelse af protoner, neutroner, elektroner samt deres betydning for stoffers egenskaber.
Inden for kemi og fysik forklarer atomteorien, hvordan vores forståelse af atomet har ændret sig gennem tiden. Engang troede man, at atomer var de mindste dele af stof. Nu ved man imidlertid, at atomer består af protoner, neutroner og elektroner. Disse subatomare partikler består af kvarker. Den første idé om atomet kom fra den græske filosof Demokrit. Mange af idéerne i den moderne teori kom fra John Dalton, en britisk kemiker og fysiker.
Teorien gælder for faste stoffer, væsker og gasser, men den gælder ikke på samme måde som for plasmaer eller neutronstjerner.
Historisk udvikling
- Antikken: Demokrit foreslog idéen om udelelige partikler — «atomos» — som byggesten i alting.
- 1800-tallet — Dalton: John Dalton formulerede en videnskabelig atommodel: elementer består af ensartede atomer, elementernes atomer har fast masse, og kemiske forbindelser dannes ved sammensætning af atomer.
- Slutningen af 1800-tallet — elektronen: Eksperimenter med katodestråler førte til opdagelsen af elektronen (J. J. Thomson), som viste, at atomet ikke var udeleligt.
- 1911 — Rutherford: Geiger og Marsden udførte guldfolie-eksperimentet under Rutherford, hvilket viste, at atomets positive masse er koncentreret i en lille kerne.
- 1913 — Bohr: Niels Bohrs model introducerede kvantiserede elektronbaner for at forklare spektrallinjer.
- 1920'erne — kvantemekanik: Schrödingers bølgefunktion og Heisenbergs matrixmekanik gav en probabilistisk model af elektrontæthed og orbitaler.
- 1930'erne: James Chadwick opdagede neutronen, og opdagelsen af kvarker senere viste, at protoner og neutroner selv er sammensat af endnu mindre partikler.
Atomets opbygning og størrelse
Et atom består af en central kerne (nukleus) med protoner og neutroner, omgivet af en sky af elektroner. Antallet af protoner i kernen (atomnummeret) bestemmer grundstoffet, mens summen af protoner og neutroner (masse tallet) afgør isotopen. Atomer har typisk en størrelse i området 0,1–0,5 nanometer (10⁻¹⁰–10⁻¹⁰ m), mens kerner er ~10⁻¹⁵ m (femtometer) – altså mange størrelsesordener mindre.
Protoner og neutroner består af kvarker bundet sammen af gluoner via den stærke kernekraft. De vigtigste kræfter i atomet er:
- Elektromagnetisk kraft: styrer tiltrækning mellem protoner og elektroner og bestemmer kemiske egenskaber.
- Stærk kernekraft: holder kvarkerne sammen i protoner og neutroner og binder nukleoner i kernen.
- Svag kraft: involveret i radioaktive henfaldsprocesser.
Moderne kvantemekanisk forståelse
Den moderne model beskriver elektroner som bølgefunktioner, hvor sandsynligheden for at finde en elektron i et område afgøres af orbitalernes form og kvantetal. Grundlæggende begreber omfatter:
- Orbitaler: regioner med høj sandsynlighed for elektrontæthed (s, p, d, f osv.).
- Elektronkonfiguration: måde elektroner er fordelt på orbitalerne; den bestemmer atomets kemiske reaktivitet og placering i det periodiske system.
- Pauli-eksklusionsprincippet: ingen to elektroner i et atom kan have samme sæt kvantetal, hvilket forklarer opbygningen af elektronisk struktur i grundstoffer.
- Spektroskopi og fotoner: emission og absorption af lys ved bestemte energiskift beviser kvantiserede energiniveauer.
Isotoper, ioner og nuklear fysik
Isotoper er varianter af samme grundstof med forskelligt antal neutroner; nogle isotoper er ustabile og gennemgår radioaktivt henfald. Ioner dannes, når et atom mister eller optager elektroner, hvilket ændrer ladningen og ofte kemisk opførsel.
Nuklear fysik studerer kernebinding, masse-defekt og bindingsenergi — principper der forklarer, hvorfor masse kan omdannes til energi i kernereaktioner (fission og fusion).
Anvendelser og begrænsninger
- Teknologi og industri: forståelsen af atomer ligger til grund for materialeforskning, halvledere, nanoteknologi og kemisk syntese.
- Energi og medicin: kernenergi, medicinsk billeddannelse og stråleterapi bygger på atomare og nukleare principper; radioisotoper bruges til diagnostik og behandling.
- Forskning: partikelacceleratorer og spektroskopi afdækker stadig finere detaljer om subatomare processer og kræfter.
- Begrænsninger: Ved høje temperaturer og ioniseringsgrader (som i plasmaer) gælder ikke længere klassiske atommodeller direkte, og i ekstremt kompakte objekter som neutronstjerner kan stof antage former, hvor individuelle atomer ikke længere eksisterer som sådan (f.eks. neutronrigt eller degenere materie, evt. kvark-materie under ekstreme forhold).
Afsluttende bemærkninger
Atomteorien er et resultat af århundreders observationer og eksperimenter og har udviklet sig fra enkle modeller til en kompleks, kvantemekanisk forståelse. Modellerne, vi bruger i dag, er ekstremt succesfulde til at forudsige kemiske og fysiske fænomener i almindelige forhold, men forskningen fortsætter for at udforske grænsetilfælde og dybere lag af materiens opbygning.

Demokrit var en græsk filosof, 460 f.Kr.

Roger Joseph Boscovich. En kroatisk jesuit, der leverede en prototype på atomteorien

John Dalton (1766-1844), engelsk kemiker og fysiker
Sir Joseph John Thomson (1856-1940), engelsk fysiker, opdagede elektronen og dens negative ladning. Han modtog Nobelprisen i fysik
Demokritos' atomteori
Demokrit mente, at hvis man skærer noget over på midten igen og igen, bliver man til sidst nødt til at stoppe. Han sagde, at dette sidste stykke stof ikke kunne skæres mindre. Demokrit kaldte disse små stykker stof for atomer, hvilket betyder "udelelige". Han mente, at atomerne ville vare evigt, aldrig forandre sig og ikke kunne ødelægges. Demokrit mente, at der ikke var noget mellem atomerne, og at alt omkring os kunne forklares, hvis vi kunne forstå, hvordan atomerne fungerede.
Nogle andre filosoffer var enige, og andre var uenige. De havde ingen mulighed for at eksperimentere for at vise, om hans teori var sand eller ej.
Boscovich's atomteori
I 1758 beskrev Roger Joseph Boscovich en forløber for atomteorien.
Daltons atomteori
I 1803 omarbejdede den engelske videnskabsmand John Dalton, født i Cumberland, Demokritos' teori på følgende måde:
- Alt stof består af atomer.
- At atomerne er udelelige og usynlige partikler.
- At atomer af det samme grundstof er af samme type og masse.
- De atomer, der indgår i kemiske forbindelser, er til stede i bestemte proportioner.
- Kemiske ændringer svarer til en omorganisering af de atomer, der deltager i den kemiske reaktion.
Dalton definerede atomet som den grundlæggende enhed i et grundstof, der kan deltage i en kemisk kombination.
Thomsons atommodel
I 1850 konstruerede Sir William Crookes et "udladningsrør", dvs. et glasrør uden luft og med metalelektroder i enderne, der er forbundet til en højspændingskilde. Når man skaber vakuum i røret, kan man se en lysudladning, der går fra katoden (negativt ladet elektrode) til anoden (positivt ladet elektrode). Crookes gav emissionen navnet "katodestråler".
Efter katodestråleeksperimenterne fastslog Sir Joseph John Thomson, at den udsendte stråle blev dannet af negative ladninger, fordi de blev tiltrukket af den positive pol. Thomson vidste, at atomerne var elektrisk neutrale, men han fastslog, at for at dette kunne ske, skulle et atom have samme mængde negative og positive ladninger. De negative ladninger blev kaldt elektroner (e-).
I overensstemmelse med de antagelser, der blev opstillet om atomernes neutrale ladning, foreslog Thomson den første atommodel, der blev beskrevet som en positivt ladet kugle, hvori elektronerne var indlejret (med negative ladninger). Den er kendt som plum pudding-modellen.
I 1906 fastslog Robert Millikan, at elektronerne havde en Coulomb-ladning (C) på -1,6 * 10−19, hvilket gjorde det muligt at beregne deres masse som lille, svarende til 9,109 * 10 −31kg.
Samtidig kunne Eugene Goldstein i 1886 ved hjælp af eksperimenter med katodeudladningsrør fastslå, at de positive ladninger havde en masse på 1,6726 * 10−27 kg og en elektrisk ladning på +1,6 * 10 C−19. Lord Ernest Rutherford gav senere disse positivt ladede partikler navnet protoner.

Skematisk fremstilling af Thomson-modellen.
Rutherfords atommodel
I 1910 fremsatte den newzealandske fysiker Ernest Rutherford den idé, at atomets positive ladninger hovedsageligt findes i atomets centrum, i atomkernen, og elektronerne (e-) omkring den.
Rutherford viste dette, da han brugte en alfastrålingskilde (fra helium) til at ramme de meget tynde guldplader, der var omgivet af en lampeskærm af zinksulfid, som producerede synligt lys, når de blev ramt af alfastråling. Dette forsøg blev kaldt Geiger-Marsden-forsøget eller Guldfolie-forsøget.
På dette tidspunkt var de vigtigste elementer i atomet klar, og man opdagede også, at atomer af et grundstof kan forekomme i isotoper. Isotoper varierer med hensyn til antallet af neutroner i kernen. Selv om denne model var velforstået, har den moderne fysik udviklet sig yderligere, og de nuværende idéer kan ikke gøres let forståelige. Nogle ideer om nutidens atomfysik kan findes i linkene i tabellen nedenfor.
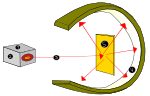
Atomeksperiment af Lord Ernest Rutherford
Moderne fysik
Atomer er ikke elementarpartikler, fordi de er lavet af subatomare partikler som protoner og neutroner. Protoner og neutroner er heller ikke elementarpartikler, fordi de består af endnu mindre partikler kaldet kvarker, der er forbundet med andre partikler kaldet gluoner (fordi de "limer" kvarkerne sammen i atomet). Kvarker er elementære partikler, fordi kvarker ikke kan opdeles yderligere.
Spørgsmål og svar
Spørgsmål: Hvad er atomteorien?
A: Atomteorien forklarer, hvordan vores forståelse af atomet har ændret sig gennem tiden.
Spørgsmål: Hvad troede man engang, at atomer var?
A: Engang troede man, at atomer var de mindste stykker stof.
Spørgsmål: Hvad består atomer egentlig af?
Svar: Atomer består af protoner, neutroner og elektroner.
Sp: Hvad består subatomare partikler af?
Svar: Subatomare partikler består af kvarker.
Sp: Hvem er den græske filosof, der først kom med idéen om atomet?
Svar: Den første idé om atomet kom fra den græske filosof Demokrit.
Spørgsmål: Hvem er den britiske kemiker og fysiker, som bidrog med mange idéer til den moderne teori?
Svar: John Dalton, en britisk kemiker og fysiker, bidrog med mange idéer til den moderne teori.
Spørgsmål: Gælder atomteorien for plasmaer eller neutronstjerner?
Svar: Teorien gælder for faste stoffer, væsker og gasser, men den gælder ikke på en måde, der svarer til plasmaer eller neutronstjerner.
Søge