Anfinsens dogme: Termodynamisk hypotese om proteinfoldning og undtagelser
Anfinsens dogme: Termodynamisk hypotese om proteinfoldning, dens begrænsninger og undtagelser — prioner, chaperoner og amyloidsygdomme forklaret kort.
Anfinsens dogme er en hypotese inden for molekylærbiologien, som Christian Anfinsen har foreslået. Idéen er, at et proteins foldning til sin oprindelige struktur sker automatisk ved hjælp af proteinets aminosyresekvens. Dogmet blev formuleret på baggrund af Anfinsens klassiske eksperimenter med enzymet ribonuklease A, hvor han viste, at et denatureret protein i nogle tilfælde kan gendanne sin native struktur og enzymatiske aktivitet alene ud fra sin sekvens og de kemiske betingelser. I praksis gælder denne idé primært for små, enkeltstående, vandopløselige proteiner under egnede in vitro-betingelser; i levende celler er der ofte brug for hjælp fra molekylære hjælpere og særlige miljøforhold. For andre proteiner er der brug for chaperoner.
Baggrund: Anfinsens eksperiment og begrænsninger
Anfinsen delte Nobelprisen i kemi i 1972 for sit arbejde med strukturen af enzymet ribonuklease A. I sine eksperimenter denaturerede han enzymet kemisk (f.eks. med urea og reducerende midler), hvorefter proteinet kunne refoldes til aktiv form, når de denaturerende forhold fjernedes. Disse resultater viste, at informationsindholdet til at nå den native struktur i disse tilfælde ligger i aminosyresekvensen. Samtidig viste Anfinsen også, at nogle aspekter af foldningen — f.eks. dannelse af korrekte disulfidbindinger — i cellen ofte kræver katalyse eller et oxiderende miljø, som ikke altid er til stede i simple in vitro-eksperimenter.
De tre krav i Anfinsens formulering
entydighed
kræver, at sekvensen ikke har nogen anden konfiguration med en tilsvarende fri energi. Med andre ord antages det, at der findes én global energimidimumsstruktur (native state), som er klart mere stabil end andre mulige strukturer.
stabilitet
små ændringer i det omgivende miljø kan ikke give anledning til ændringer i minimumskonfigurationen. Det betyder, at den native struktur er robust over for små variationer i temperatur, pH eller ionstyrke inden for et passende interval.
kinetisk tilgængelighed
betyder, at man kan få den endelige form uden at foretage meget komplekse ændringer i formen (som f.eks. knuder). Det forudsætter, at foldningsvejen fra den udfoldede til den native tilstand er kinetisk realistisk og ikke kræver umuligt lange og tilfældige søgninger i konformationsrummet.
Levinthals paradoks og foldningslandskabet
Hvordan proteinet når frem til denne struktur er emnet for proteinfoldning, som har et beslægtet dogme kaldet Levinthals paradoks. Levinthals paradoks siger, at antallet af mulige konformationer, der er til rådighed for et givet protein, er astronomisk stort, således at selv et lille protein på 100 rester ville kræve mere tid end universet har eksisteret til at udforske alle mulige konformationer (10 26 sekunder) og vælge den passende.
Den moderne løsning på paradokset er begrebet et energilandskab eller en foldnings-"funnel": proteinets lokale interaktioner og kooperativitet biaser foldningen mod native tilstanden, så der dannes vejledende foldningsveje og mellemliggende strukturer frem for en tilfældig, fuldstændig søgning. Dermed kan proteiner foldes hurtigt og reproducerbart. Dog findes der stadig kinetiske fælder, mellemliggende tilstande og mulige aggregationsveje, som kan gøre foldningen vanskelig.
Undtagelser og begrænsninger
Prioner er en tydelig undtagelse fra Anfinsens dogme. Prioner er alternative, særdeles stabile konformationer af proteiner, som adskiller sig fra den oprindelige foldningstilstand. Ved bovin spongiformencephalopati (kogalskab) omfolder de oprindelige proteiner sig til en anden stabil konformation, hvilket forårsager en dødelig amyloidophobning. Denne omfoldning kan fungere som en skabelon (seeding), så den alternative konformation kan sprede sig mellem molekyler og i nogle tilfælde mellem individer. Andre amyloidsygdomme, herunder Alzheimers sygdom og Parkinsons sygdom, involverer også dannelsen af alternative stabile aggregater og kan ses som undtagelser eller udvidelser af Anfinsens oprindelige idé.
Der er flere andre situationer, hvor Anfinsens simple formulering ikke rækker til:
- Chaperon-afhængige proteiner: Mange store eller komplekse proteiner foldes ikke korrekt uden hjælp fra molekylære chaperoner (eksempler: GroEL/GroES, Hsp70-systemet). Chaperoner beskytter mod aggregation og kan levere et isoleret miljø, hvor foldningen kan ske sikkert.
- Membranproteiner og komplekse miljøer: Membranproteiner kræver lipidmiljøet for korrekt foldning, og proteiner bundet til membraner eller store komplekse samleformationer (f.eks. flerproteinkomplekser) kan ikke foldes korrekt i simpel opløsning.
- Post-translationelle modifikationer og cofaktorer: Nogle proteiner kræver indbygning af metalioner, heme eller andre cofaktorer for at opnå deres funktionelle foldning. Disulfidbroer dannes ofte katalytisk i det oxiderende miljø i endoplasmatisk retikulum ved hjælp af enzymer som PDI.
- Intrinsisk uordnede proteiner (IDP'er): Mange proteiner eller domæner er naturligt uordnede og antager først en veldefineret struktur ved binding til partnere eller ved ændringer i miljøet. For disse gælder ikke en enkelt, permanent native struktur.
- Aggregering og kinetiske fælder: Under visse betingelser kan foldning lede til irreversibel aggregation eller indespærrede, ikke-funktionelle tilstande, især ved høj koncentration eller stress.
Praktisk betydning
Anfinsens dogme var afgørende for forståelsen af, at den primære aminosyresekvens rummer meget af den information, der bestemmer et proteins tredimensionelle struktur. I dag anvendes princippet i proteinstrukturforudsigelser og bioinformatik, men med forståelsen af, at cellulære forhold, hjælpemolekyler, co-faktorer og sygdomsrelaterede omfoldninger kan ændre eller komplimentere den enkle model.
Sammenfattende gælder Anfinsens ide stadig som et vigtigt teoretisk grundlag: sekvensen er fundamental for struktur. Men i praksis må man tage højde for en række biologiske undtagelser og mekanismer (chaperoner, membranmiljø, cofaktorer, IDP'er og patologiske omfoldninger som prioner og amyloider), som udvider og nuancerer det oprindelige dogme.
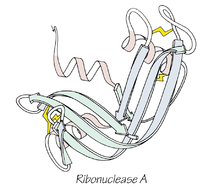
Foldet 3D-struktur af ribonuklease A
Spørgsmål og svar
Q: Hvad er Anfinsens dogme?
A: Anfinsens dogme er en hypotese inden for molekylærbiologien foreslået af Christian Anfinsen, der antyder, at et proteins foldning til sin oprindelige struktur sker automatisk ved hjælp af proteinets aminosyresekvens.
Sp: Hvad er de tre betingelser for entydighed, stabilitet og kinetisk tilgængelighed?
Svar: Unikhed kræver, at sekvensen ikke har nogen anden konfiguration med en tilsvarende fri energi. Stabilitet betyder, at små ændringer i det omgivende miljø ikke kan give anledning til ændringer i minimumskonfigurationen. Kinetisk tilgængelighed betyder, at den endelige form kan opnås uden at gennemgå meget komplekse ændringer i formen (som f.eks. knuder).
Spørgsmål: Hvad er Levinthals paradoks?
Svar: Levinthals paradoks siger, at antallet af mulige konformationer, der er tilgængelige for et givet protein, er astronomisk stort, således at selv et lille protein på 100 rester ville kræve mere tid, end universet har eksisteret, til at udforske alle mulige konformationer (1026 sekunder) og vælge den passende konformation.
Spørgsmål: Er der nogen undtagelser fra Anfinsens dogme?
A: Ja, prioner og amyloide sygdomme som f.eks. bovin spongiform encephalopati (kogalskab), Alzheimers sygdom og Parkinsons sygdom er undtagelser fra Anfinsens dogme.
Spørgsmål: Hvordan fik Christian Anfinsen sin Nobelpris?
Svar: Christian Anfinsen fik sin Nobelpris i kemi for sit arbejde med strukturen af enzymet ribonuklease A.
Spørgsmål: Hvordan adskiller prioner sig fra den oprindelige foldningstilstand?
Svar: Prioner er stabile konformationer af proteiner, som adskiller sig fra den oprindelige foldningstilstand.
Søge