Molekylære chaperoner: Proteinfoldning, typer og funktion
Molekylære chaperoner: forstå proteinfoldning, typer og funktioner — hvordan chaperoner forebygger aggregation, assisterer foldning og organiserer makromolekylære strukturer.
Molekylære chaperoner er proteiner, der hjælper andre store molekyler — især nydannede eller delvist udfoldede polypeptider — med at folde korrekt eller undgå forkert foldning og sammenklumpning. De kan også bistå ved samling eller adskillelse af andre makromolekylære komplekser. Chaperoner indgår typisk ikke i de endelige, funktionelle strukturer, men virker midlertidigt for at sikre, at komponenterne når en funktionel tilstand.
Det første protein, der blev kaldt en chaperon, assisterede i samlingen af nukleosomer ved at koordinere foldede histoner og DNA. Særligt i cellekernen findes chaperoner, som hjælper med at samle foldede underenheder til større strukturer og komplekser — fra nukleosomer til større subcellulære enheder som f.eks. celleorganeller.
En af chaperonernes vigtigste opgaver er at forhindre, at polypeptidkæder og sammensatte underenheder klistrer sig sammen i ikke-funktionelle aggregater. Nogle chaperoner fungerer primært som holdaser, som binder til og stabiliserer ufuldstændigt foldede polypeptider for at forhindre aggregation. Andre virker som foldaser, der aktivt fremmer korrekt foldning af proteiner, som ellers ikke vil nå deres native struktur alene. Denne assistance kan betyde, at visse proteiner ikke følger den enkle udlægning af Anfinsens dogme, som siger, at den information, der bestemmer et proteins tredimensionelle struktur, udelukkende ligger i aminosyresekvensen.
Typer af chaperoner
- Hsp70-familien: Almindelige, ATP-afhængige chaperoner, der binder til korte, hydrofobe sekvenser i udfoldede polypeptider og forhindrer aggregation samt bistår i tilbagedannelse efter stress.
- Chaperoniner (f.eks. Hsp60 / GroEL–GroES): Større, ringformede komplekser, der tilbyder et beskyttet kammer hvor et protein kan folde uden risiko for kobling til andre polypeptider.
- Hsp90-familien: Vigtige for modning af mange signaleringsproteiner, herunder kinaser og receptorer; ofte involveret senere i foldningsprocessen.
- Små heat shock-proteiner: Handler ofte som holdaser og danner oligomere netværk som kan binde udfoldede proteiner indtil andre chaperoner tager over.
- ER-chaperoner: Som BiP, calnexin og calreticulin hjælper ved korrekt foldning i endoplasmatisk retikulum og er centrale i kvalitetskontrol af sekretoriske proteiner.
- Nukleosom-chaperoner: Specialiserede chaperoner i kernen, som organiserer histoner og DNA ved kromatinopsætning.
Mekanisme og funktioner
- Forebyggelse af aggregation: Chaperoner binder til eksponerede hydrofobe områder på ufuldstændigt foldede proteiner for at undgå uønsket sammenklumpning.
- Fremme af korrekt foldning: Nogle chaperoner tilbyder gentagne bindings- og frigivelsessykluser, ofte drevet af ATP hydrolyse, der hjælper proteinet over kinetiske barrierer.
- Samling af komplekser: De assisterer ved samling af multiproteinkomplekser og sikrer, at underenheder mødes i korrekt rækkefølge og konformation.
- Kvalitetskontrol og degradering: Chaperoner kan dirigere uopretteligt fejlfoldede proteiner til degraderingsveje som proteasomet eller autofagi.
- Reaktion på stress: Under varmechok, oxidation eller andre stressformer opreguleres mange chaperoner (heat-shock-proteiner) for at beskytte celleproteomet.
Biologisk betydning og sygdom
Chaperoners aktivitet er afgørende for cellens proteinhomeostase (proteostase). Når chaperonesystemet svigter eller er utilstrækkeligt, kan det føre til ophobning af toksiske proteinaggregater, hvilket ses ved flere neurodegenerative sygdomme som Alzheimers, Parkinsons og Huntington. Derudover kan nogle kræftceller udnytte chaperoner til at stabilisere muterede onkoproteiner, hvilket gør chaperoner til interessante mål for lægemiddeludvikling.
Anvendelser og forskningsperspektiver
Chaperoner studeres intensivt i både grundforskning og bioteknologi. Eksempler på anvendelser og fokusområder:
- Design af medicin, der hæmmer eller modulérer specifikke chaperoner i sygdomme.
- Brug af chaperoner i rekombinant proteinproduktion for at øge udbytte og korrekt foldning af svære proteiner.
- Studier af chaperoners rolle i aldring og cellulær stresstolerance.
Sammenfattende fungerer molekylære chaperoner som cellens assistanceprogram for proteiner: de forhindrer skadelige interaktioner, hjælper med korrekt foldning og sikrer, at proteiners funktionelle struktur opnås eller genoprettes efter stress. Deres rolle er central for både normal cellefunktion og ved mange sygdomstilstande.
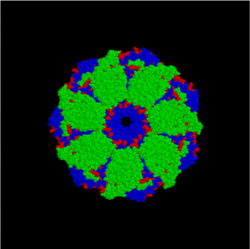
Et top-view af et bakterielt chaperonkompleks
Spørgsmål og svar
Q: Hvad er en molekylær chaperone?
Svar: En molekylær chaperon er et protein, der hjælper med proteinfoldningen.
Sp: Hvad er den vigtigste rolle for en molekylær chaperon?
Svar: En molekylær chaperons hovedrolle er proteinfoldning.
Sp: Findes molekylære chaperoner i makromolekylære strukturer under strukturernes normale funktioner?
Svar: Nej, molekylære chaperoner forekommer ikke i makromolekylære strukturer under deres normale funktioner.
Sp: Hvad er nogle af de ting, som molekylære chaperoner gør ved proteiner?
Svar: Molekylære chaperoner kan folde over halvdelen af alle pattedyrproteiner, udfolde proteiner, samle proteiner og adskille proteiner.
Spørgsmål: Hvad var det første protein, der blev kaldt en chaperon, og hvad gjorde det?
Svar: Det første protein, der blev kaldt chaperon, hjælper med at samle nukleosomer fra foldede histoner og DNA.
Spørgsmål: Hvad er en af chaperonernes vigtigste funktioner?
Svar: En af chaperonernes vigtigste funktioner er at forhindre, at polypeptidkæder og underenheder klistrer sammen i klumper, som ikke fungerer.
Spørgsmål: Hvad er forskellen mellem "holdaser" og "foldaser"?
Svar: "Holdaser" virker for at stoppe aggregering, mens "foldaser" hjælper med at folde proteiner, som ikke selv kan folde dem.
Søge