Molekylære vibrationer: Definition, typer og eksempler i kemi
Molekylære vibrationer: Klar definition, gennemgang af vibrationstyper og konkrete kemi-eksempler — lær strækning, bøjning og spektralanalyse for H2, N2, O2 m.fl.
Molekylære vibrationer er en af tre forskellige former for bevægelse for molekyler, herunder translationsbevægelse (når hele molekylet bevæger sig i samme retning) og rotationsbevægelse (når molekylet drejer rundt som en top).
En vibrationsbevægelse for et molekyle er, når bindingerne mellem atomerne i et molekyle bevæger sig. Tænk på atomerne som runde kugler, der er forbundet med en fjeder, som kan strække sig frem og tilbage. Et eksempel på denne bevægelse er "strækning", som er det enkleste eksempel på en vibration for et molekyle og opstår mellem blot to atomer. Nogle eksempler på molekyler, der er sådan, er brint H2 , nitrogen N2 og oxygen O 2.
Hvad menes med en vibrationsmode?
Vibrationsmode (eller normalmode) er en selvstændig måde, hvorpå et molekyle kan vibrere, så alle atomer bevæger sig med faste relative faser og amplituder. For et molekyle med N atomer findes der:
- 3N–5 vibrationsmodi for lineære molekyler,
- 3N–6 vibrationsmodi for ikke-lineære (typiske) molekyler.
Eksempel: CO2 (lineært, N=3) har 3·3–5 = 4 vibratonsmodi (symmetrisk stræk, asymmetrisk stræk og to degenerate bøjninger). H2O (ikke-lineært, N=3) har 3·3–6 = 3 modi (symmetrisk stræk, asymmetrisk stræk og bøjning).
Typer af vibrationer
De almindeligste typer vibrationer i polyatomiske molekyler er:
- Strækning (stretching) — bindingens længde ændres (kan være symmetrisk eller asymmetrisk).
- Bøjning (bending) — bindingsvinkler ændres; underkategorier: scissoring, rocking, wagging og twisting.
- Deformationer og torsion — mere komplekse bevægelser i større molekyler.
Fysisk model og frekvensafhængighed
En enkel klassisk model er den harmoniske oscillator: to atomer forbundet med en "fjeder" karakteriseret ved en kraftkonstant k. For en diatomisk binding afhænger vibrationsfrekvensen af:
- bindingens styrke (større k → højere frekvens),
- reduceret masse μ for de to atomer (større μ → lavere frekvens).
Den karakteristiske bølgetal (i cm−1) for en harmonisk oscillator kan skrives som ν̃ = (1/2πc)·√(k/μ), hvor c er lysets hastighed. Reduceret masse er μ = m₁m₂/(m₁+m₂). I praksis måles ofte frekvenser som bølgetal (cm−1); typiske vibrationer med kovalente bindinger ligger i området ca. 400–4000 cm−1, mens tunge atombindinger vibrerer lavere.
Spektroskopiske konsekvenser: IR og Raman
Vibrationsenergier er direkte målbare ved spektroskopi:
- IR-spektroskopi: En vibrationsmode er IR-aktiv, hvis der sker en ændring i molekylets dipolmoment under vibration. Homonukleare diatomiske molekyler som brint H2, nitrogen N2 og oxygen O 2 har ingen ændring i dipol ved strækning og er derfor IR-inaktive (slikker ikke i IR), men de kan være aktive i andre teknikker.
- Raman-spektroskopi: En vibrationsmode er Raman-aktiv, hvis polariserbarheden af molekylet ændres under vibration. Mange vibrationer, der er svage eller fraværende i IR, ses klart i Raman.
Valget mellem IR og Raman giver komplementær information om molekylets struktur og bindingstyper. Andre teknikker omfatter inelastisk neutronspredning, sum-frequency generation og femtosekund pump–probe-spektroskopi til at studere tidsresolvente vibrationsdynamikker.
Anharmonicitet, overtoner og temperatur
Den harmoniske oscillator er en tilnærmelse; i virkeligheden er potentialet anharmonisk. Det medfører:
- afvigelser fra lige energisnit (overtoner og kombinationsbånd optræder),
- temperaturafhængig linjebredde og befolkningsfordeling (Boltzmann-fordeling over niveauer),
- mulighed for energioverførsel mellem vibrationer (vibrations‑vibrations relaxation) og til oversatte eller roterende grader af frihed.
Praktiske eksempler og anvendelser
- Identifikation af funktionelle grupper: I organisk kemi bruges IR-spektre til at genkende grupper som OH (bånd ~3200–3600 cm−1), C=O (~1650–1750 cm−1), C–H (~2800–3100 cm−1) osv.
- Materialekarakterisering: Vibrationsspektre fortæller om krystallinske vs. amorfe materialer, bindingstyper og substitutioner.
- Reaktionsmekanismer: Overvågning af bindingsbrud og -dannelse i realtid med ultrahurtig spektroskopi.
- Atmosfærisk og miljøanalyse: Gasser og forurenende stoffer påvises via deres karakteristiske vibrationslinjer.
Afsluttende bemærkninger
Vibrationsspektroskopi er et kraftfuldt værktøj til at forstå molekylstrukturer, bindingers styrke og dynamik. Kendskab til antallet af vibrationsmodi, de mest almindelige vibrationsformer og de spektroskopiske selektionsregler gør det muligt at fortolke spektre korrekt og anvende dem i forskning og industri.
Typer af vibrationer
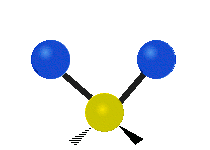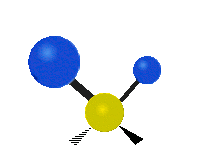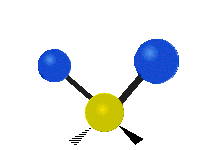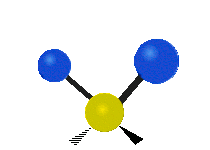
Hvis molekylet har mere end to atomer, bliver det mere kompliceret. Lad os antage, at der tilføjes blot et atom mere, så der nu er tre atomer som i vand H2 O, hvor de to hydrogenatomer begge er knyttet til det centrale oxygenatom. Husk, at der med brint var én slags strækning, men i vand er der to slags strækning og fire andre slags vibrationer kaldet bøjningsvibrationer, som vist nedenfor.
Atomerne i en CH2 gruppe eller molekyler som f.eks. vand kan vibrere på seks forskellige måder: symmetrisk og antisymmetrisk strækning, saksering, vugning, vridning og vridning:
| Symmetrisk strækning | Antisymmetrisk strækning | Saksning |
|
|
|
|
| Vuggende | Wagging | Vridning |
|
|
|
|
symmetrisk strækning: når de to vedhæftede atomer bevæger sig væk fra og mod det centrale atom på samme tid.
antisymmetrisk strækning: Når de to vedhæftede atomer ikke bevæger sig væk fra og mod det centrale atom på samme tid.
saksning: Som navnet siger, er saksering, når de to atomer bevæger sig væk og hen imod hinanden.
rocking: Denne bevægelse er som et pendul på et ur, der går frem og tilbage, men her er et atom pendulet, og der er to i stedet for et.
viftende: Hvis en person holder hånden op foran sig og sætter sine to fingre i et "V"-tegn og bøjer håndleddet mod og væk fra sig selv. Her er fingerspidserne de tilknyttede atomer, og håndleddet er det centrale atom.
vridning: Denne bevægelse er som om en person går på et løbebånd, hvor deres talje er det centrale atom og deres fødder er de to vedhæftede atomer.
Molekyler med mere end tre atomer
Molekyler med mere end tre atomer er endnu mere komplicerede og har endnu flere vibrationer, som nogle gange kaldes "vibrationsformer". Hver ny vibrationstilstand er i princippet en anden kombination af de seks ovenfor viste. Jo flere atomer i molekylet, jo flere måder kan de kombineres på. For de fleste molekyler med N atomer er antallet af mulige vibrationer for det pågældende molekyle 3N - 6, mens lineære molekyler, eller molekyler med atomerne i en lige linje, har 3N-5 vibrationsformer.
Forholdet mellem energi og vibrationer
Newtonsk mekanik
Ved hjælp af Newtonsk mekanik kan molekylets vibrationer beregnes ved at behandle bindingerne som fjedre. Dette er nyttigt, fordi en binding ligesom en fjeder kræver energi for at strække den ud, og det kræver også energi at klemme den sammen. Den energi, der er nødvendig for at strække eller klemme bindingen sammen, afhænger af bindingens stivhed, som repræsenteres af fjederkonstanten k, og den reducerede masse eller "massemidtpunktet" for de to atomer, der er knyttet til hver ende, angivet med μ. Den formel, der anvendes til at relatere den energi, der er nødvendig for at forårsage en vibration i bindingen, er:
E = h ν = h 2 π k μ . {\displaystyle \ E=h\nu ={h \over {2\pi }}{\sqrt {k \over \mu }}.\! }
h: er Plancks konstant
ν: er frekvensen og repræsenterer den hastighed, hvormed bindingen presses sammen og trækkes fra hinanden igen. Jo større ν, jo hurtigere bliver denne hastighed.
Ε: er den energi, der kræves for at skubbe og trække bindingen sammen.
μ: Den reducerede masse er de to atomers masse ganget sammen og divideret med deres addition:
μ = m 1 m 2 m 1 m 1 + m 2 . {\displaystyle \mu ={m_{1}m_{2} \over m_{1}+m_{2}}}.\! }
Kvantemekanik
Ved hjælp af kvantemekanikken er formlen, der beskriver fjederen, nøjagtig den samme som den newtonske mekanik, bortset fra at kun visse energier eller energiniveauer er tilladt. Tænk på energiniveauerne som trin på en stige, hvor en person kun kan gå op eller ned ad et trin ad gangen. Ligesom denne person ikke kan stå på mellemrummet mellem trinene, kan bindingen heller ikke have en energi mellem energiniveauerne. Denne nye formel bliver:
E n = h ν = h ( n + 1 2 ) 1 2 π k m {\displaystyle E_{n}=h\nu =h\left(n+{{1 \over 2}\right){1 \over {2\pi }}{\sqrt {k \over m}}}\! } 
hvor n er et kvantetal eller "energiniveau", der kan have værdierne 0, 1, 2 ... Udsagnet om, at energiniveauer kun kan gå op eller ned på ét niveau ad gangen, er kendt som en udvælgelsesregel, som siger, at de eneste tilladte overgange mellem energiniveauer er:
Δ n = ± 1 {\displaystyle \Delta n=\pm 1}
hvor \Delta n er energiovergangen.
Anvendelse af vibrationsbevægelser
Når lys med en bestemt frekvens rammer et molekyle, der har en vibration, hvis bevægelse svarer til samme frekvens, absorberes lyset af molekylet, og energien fra lyset får bindingerne til at bevæge sig i den specifikke vibrationsbevægelse. Ved at undersøge, om lyset bliver absorberet, kan forskerne se, om der er en bestemt type molekylær binding og sammenligne den med en liste over molekyler, der har den pågældende binding.
Nogle molekyler som helium og argon har dog kun ét atom og har ingen bindinger. Det betyder, at de ikke absorberer lys på samme måde som et molekyle med mere end ét atom kan.
De specifikke kemiområder, der anvender molekylære vibrationer i deres undersøgelser, omfatter infrarød spektroskopi (IR) og Raman-spektroskopi (Raman), idet IR er mere udbredt og har tre egne underområder. Disse underområder er kendt som nær-IR-, mellem-IR- og fjern-IR-spektroskopi. Nedenfor følger en generel liste over disse områder og deres anvendelser i den virkelige verden
Nær IR: kvantitativ bestemmelse af arter som proteiner, fedtstoffer, kulbrinter med lav lav molekylvægt og vand. Yderligere anvendelse i landbrugs-, fødevare-, olie- og kemikalieindustrien.
Mid IR: Det mest populære af IR-felterne bruges til at bestemme strukturen af organiske og biokemiske forbindelser.
Fjern IR: dette område er mindre populært, selv om det har fundet anvendelse i uorganiske undersøgelser
Raman: Anvendes til kvalitativ og kvantitativ undersøgelse af uorganiske, organiske og biologiske systemer, ofte som en supplerende teknik til IR.
Søge