Carbokation
En karbokation er en ion med et positivt ladet kulstofatom. Det ladede kulstofatom i en karbokation er en "sekstet" (det vil sige, at det kun har seks elektroner i sin ydre valensskal i stedet for otte valenselektroner). Kulstofatomer med otte valensvalg har den maksimale stabilitet (oktetreglen). Derfor er carbocationer ofte reaktive, idet de søger at udfylde oktetten af valenselektroner samt at genvinde en neutral ladning. Logikken ville sige, at carbocation har 3sp-hybridisering med en tom 3sp-orbital, der giver positiv ladning. Men reaktiviteten af en karbokation ligner mere en 2sp-hybridisering med en trigonal plan molekylær geometri.
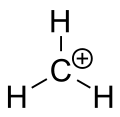
Carbeniumion af methan

tert-butyl-kation, der viser planar geometri
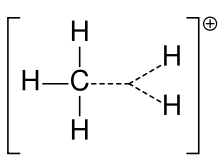
Carboniumion af methan
Definitioner
En karbokation blev tidligere ofte kaldt en carboniumion, men kemikere sætter spørgsmålstegn ved den nøjagtige betydning. I nutidens kemi er en karbokation et positivt ladet kulstofatom. Der er blevet foreslået to specielle typer: carbeniumioner er treværdige og carboniumioner er fem- eller seksværdige. I lærebøger på universitetsniveau omtales carbocationer kun som om de er carbeniumioner, eller de omtales med en flygtig henvisning til den ældre sætning carboniumion eller carbenium- og carboniumioner. En lærebog holder den dag i dag fast ved den ældre betegnelse carboniumion for carbeniumion og forbeholder udtrykket hypervalent carbeniumion for CH5+.
Historie
I 1891 rapporterede G. Merling, at han tilsatte brom til tropyliden (cycloheptatrien) og derefter opvarmede produktet for at opnå et krystallinsk, vandopløseligt materiale, C
7H
7Br. Han foreslog ikke en struktur for det, men Doering og Knox viste overbevisende, at det var tropylium (cycloheptatrienylium)-bromid. Denne ion forudsiges at være aromatisk efter Hückel-reglen.
I 1902 opdagede Norris og Kehrman uafhængigt af hinanden, at farveløs triphenylmethanol gav dybt gule opløsninger i koncentreret svovlsyre. Triphenylmethylchlorid dannede ligeledes orange komplekser med aluminium- og tinchlorider. I 1902 erkendte Adolf von Baeyer, at de dannede forbindelser havde saltlignende karakter.

Han kaldte forholdet mellem farve og saltdannelse for halokromi, som malakitgrønt er et godt eksempel på.
Carbocationer er reaktive mellemprodukter i mange organiske reaktioner. Denne idé, der først blev foreslået af Julius Stieglitz i 1899, blev videreudviklet af Hans Meerwein i hans undersøgelse af Wagner-Meerwein-omlægningen i 1922. Carbocationer blev også fundet involveret i NS1-reaktionen, E1-reaktionen og i omlægningsreaktioner som Whitmore 1,2 shift-reaktionen. Det kemiske etablissement var tilbageholdende med at acceptere begrebet karbokation, og i lang tid nægtede Journal of the American Chemical Society artikler, der omtalte dem, at blive offentliggjort.
Det første NMR-spektrum af en stabil karbokation i opløsning blev offentliggjort af Doering et al. i 1958. Det var heptamethylbenzenoniumionen, der blev fremstillet ved at behandle hexamethylbenzen med methylchlorid og aluminiumchlorid. Den stabile 7-norbornadienylkation blev fremstillet af Story et al. i 1960 ved at lade norbornadienylchlorid reagere med sølvtetrafluoroborat i svovldioxid ved -80 °C. NMR-spektret viste, at den var ikke-klassisk brolagt (den første stabile ikke-klassiske ion, der blev observeret).
I 1962 observerede Olah direkte tert-butylkarbokationen ved hjælp af kernemagnetisk resonans som en stabil art ved opløsning af tert-butylfluorid i magisk syre. NMR af norbornylkationen blev først rapporteret af Schleyer et al. og det blev vist, at den undergår proton-scrambling over en barriere af Saunders et al.
Egenskaber
I organisk kemi er en karbokation ofte målet for nukleofilt angreb fra nukleofile stoffer som hydroxyl-(OH−)-ioner eller halogenioner.
Carbocationer klassificeres som primære, sekundære eller tertiære afhængigt af antallet af kulstofatomer, der er bundet til det ioniserede kulstof. Primære karbokationer har et eller nul kulstofatomer bundet til det ioniserede kulstof, sekundære karbokationer har to kulstofatomer bundet til det ioniserede kulstof, og tertiære karbokationer har tre kulstofatomer bundet til det ioniserede kulstof.
Karbokationens stabilitet øges med antallet af alkylgrupper, der er bundet til det ladningsbærende kulstof. Tertiære karbokationer er mere stabile (og dannes lettere) end sekundære karbokationer; primære karbokationer er meget ustabile, fordi mens ioniserede carbonhydrider af højere orden er stabiliseret ved hyperkonjugering, er usubstituerede (primære) carbonhydrider ikke stabiliseret ved hyperkonjugering. Derfor forekommer reaktioner som NS1-reaktionen og E1-elimineringsreaktionen normalt ikke, hvis der dannes en primær carbocation. En undtagelse herfra opstår, når der er en kulstof-kulstof-dobbeltbinding ved siden af det ioniserede kulstof. Sådanne kationer som allylkation CH=CH-CH22+ og benzylkation6 CH-CH52+ er mere stabile end de fleste andre carbocationer. Molekyler, der kan danne allyl- eller benzylcarbocationer, er særligt reaktive.
Karbocationer gennemgår omlægningsreaktioner fra mindre stabile strukturer til lige så stabile eller mere stabile strukturer med hastighedskonstanter på over 10/sek9. Denne kendsgerning komplicerer de syntetiske veje til mange forbindelser. Når f.eks. 3-pentanol opvarmes med vandigt HCl, omarrangeres den oprindeligt dannede 3-pentylkarbokation til en statistisk blanding af 3-pentyl og 2-pentyl. Disse kationer reagerer med chloridionerne og danner ca. 1/3 3-chlorpentan og 2/3 2-chlorpentan.
Nogle carbocationer som f.eks. norbornylkationen udviser mere eller mindre symmetrisk binding af tre centre. Kationer af denne art er blevet betegnet som ikke-klassiske ioner. Energiforskellen mellem "klassiske" carbocationer og "ikke-klassiske" isomerer er ofte meget lille, og der er generelt meget lidt eller slet ingen aktiveringsenergi involveret i overgangen mellem "klassiske" og "ikke-klassiske" strukturer. Den "ikke-klassiske" form af 2-butylkarbokationen er i det væsentlige 2-buten med en proton direkte over midten af det, der ville være kulstof-kulstof-dobbeltbindingen. "Ikke-klassiske" carbocationer var engang genstand for stor kontrovers. Et af George Olahs største bidrag til kemien var at løse denne kontrovers.
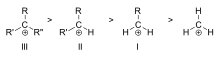
Stabilitetsrækkefølge for eksempler på tertiære (III), sekundære (II) og primære (I) alkylcarbocationer
Specifikke carbocationer
Cyclopropylcarbinyl-kationer kan undersøges ved NMR:

I NMR-spektret af et dimethylderivat findes der to ikke-ækvivalente signaler for de to methylgrupper, hvilket indikerer, at den molekylære konformation af dette kation ikke er vinkelret (som i A), men er todelt (som i B) med den tomme p-orbital og cyclopropylringssystemet i samme plan:

I teorien om bøjede bindinger forklares denne præference ved at antage en gunstig orbitaloverlapning mellem de fyldte bøjede bindinger af cyclopropan og den tomme p-orbital.
Spørgsmål og svar
Spørgsmål: Hvad er en karbokation?
Svar: En karbokation er en ion med et positivt ladet kulstofatom.
Spørgsmål: Hvad er den ydre valensskal for en karbokation?
Svar: Den ydre valensskal i en karbokation har kun seks elektroner i stedet for de stabile otte valenselektroner.
Spørgsmål: Hvorfor er karbokationer ofte reaktive?
Svar: Karbokationer er ofte reaktive, fordi de søger at udfylde oktetten af valenselektroner og genvinde en neutral ladning.
Spørgsmål: Hvad er den maksimale stabilitet for kulstofatomer?
Svar: Kulstofatomer har den maksimale stabilitet, når de har otte valenselektroner.
Spørgsmål: Hvad er en sekstet i kemi?
Svar: En sekstet er en betegnelse for et kulstofatom i en karbokation, som kun har seks elektroner i sin ydre valensskal i stedet for de stabile otte valenselektroner.
Sp: Hvad er hybridiseringen og den molekylære geometri af en karbokation?
Svar: Selv om logikken ville antyde, at carbocationer har sp3-hybridisering med en tom sp3-orbital, der giver en positiv ladning, ligner deres reaktivitet snarere sp2-hybridisering med en trigonal plan molekylær geometri.
Spørgsmål: Hvad er oktetreglen?
Svar: Oktetreglen er et princip i kemi, der siger, at atomer har tendens til at danne kemiske bindinger med andre atomer, der gør det muligt for begge atomer at have et stabilt sæt af otte valenselektroner.
Søge