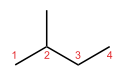Strukturel isomeri (konstitutionel): Definition, typer og eksempler
Lær strukturel (konstitutionel) isomeri: klar definition, forskel fra stereoisomeri, og gennemgang af skelet-, positions- og funktionelle isomerer med illustrative eksempler.
Strukturel isomeri (IUPAC kalder det konstitutionel isomeri) er en form for isomeri. To kemiske stoffer i denne isomeri har den samme molekylformel, men molekylerne er bundet sammen i forskellige rækkefølger. Det modsatte af strukturel isomeri er stereoisomeri. Der er mange ord, der repræsenterer strukturelle isomerer.
Hvad betyder det i praksis?
At to stoffer er strukturelle isomerer betyder, at de indeholder præcis det samme antal og typer af atomer, men at forbindelsernes atomforbindelser (connectivity) er forskellige. Denne forskel i forbindelserne fører ofte til markant forskellige fysiske og kemiske egenskaber — for eksempel kogepunkt, smeltepunkt, opløselighed og reaktivitet — selvom molekylformlen er identisk.
Typer af konstitutionelle isomerer
Der findes tre hovedtyper af konstitutionelle isomerer:
- Skeletisomerer (konguration af kulstofkæden): Isomerer med samme molekylformel, men forskellig carbon-skelet (lineær vs. forgrenet). Eksempel: C4H10 findes som n-butan (lineær) og isobutan (forgrenet).
- Positionsisomerer (regioisomerer): Samme funktionelle gruppe og samlet struktur, men funktionelle grupper eller substituenter sidder på forskellige positioner i skeletet. Eksempel: 1-chlorpropan vs 2-chlorpropan.
- Funktionelle isomerer: Stoffer med samme molekylformel, men forskellige funktionelle grupper, hvilket giver helt forskellige klasser af forbindelser. Eksempel: ethanol (en alkohol) og dimethyl ether (en ether), begge har formel C2H6O.
Tautomerer — en særlig undergruppe
Tautomerer beskrives ofte som en særlig type funktionel isomeri, hvor to former kan omdannes let indbyrdes, typisk ved flytning af en proton og en ændring i dobbeltbindingers placering. Et almindeligt eksempel er keto–enol-tautomerisme, hvor en keton og en tilsvarende enol er i ligevægt. Tautomerisering sker ofte hurtigt og kan være katalyseret af syrer eller baser.
Hvordan adskiller det sig fra stereoisomeri og konformationsisomeri?
Det er vigtigt at skelne konstitutionel isomeri fra andre typer isomeri:
- Stereoisomeri: Her er atomforbindelserne identiske, men den rumlige orientering af atomerne er forskellig (fx enantiomerer og diastereomerer).
- Konformationsisomeri: Skyldes rotation omkring enkeltbindinger; disse former kan ofte omdannes til hinanden uden at bryde kovalente bindinger og betragtes normalt ikke som forskellige forbindelser i streng forstand.
Hvorfor er strukturel isomeri vigtig?
Strukturel isomeri har stor betydning i kemi og anvendelser som medicinalkemi, materialekemi og syntetisk kemi, fordi forskellige isomerer kan have helt forskellige biologiske virkninger eller materialeegenskaber. Derfor er korrekt identifikation og navngivning afgørende.
Hvordan identificeres strukturelle isomerer?
Forskellige analytiske metoder anvendes til at skelne strukturelle isomerer:
- NMR-spektroskopi: Viser forskelle i kemiske miljøer for hydrogen- og kulstofatomer.
- IR-spektroskopi: Afslører forskellige funktionelle grupper gennem karakteristiske vibrationsbånd.
- Massespektrometri: Kan give fragmenteringsmønstre, der peger på forskellig struktur.
- Kromatografi: Adskiller isomerer baseret på interaktion med stationære/flytende faser og forskelle i polaritet.
- Fysiske målinger: Kogepunkt, smeltepunkt og opløselighed kan ofte indikere forskelle mellem isomerer.
Samlet set er strukturel (konstitutionel) isomeri et grundlæggende begreb i organisk kemi, der forklarer, hvordan samme atomsammensætning kan give forskellige forbindelser med forskellige egenskaber og anvendelser.
Skelet-isomeri
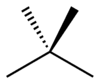
Ved skelet-isomeri eller kædeisomeri omorganiseres komponenter af skelettet (normalt kulstof) for at skabe forskellige strukturer. Pentan har tre isomerer. De er n-pentan (ofte blot kaldet "pentan"), isopentan (methylbutan) og neopentan (dimethylpropan).
| Skeletisomeri af pentan | ||
|
|
|
|
| n-Pentan | Isopentan | Neopentan |
Positionsisomeri
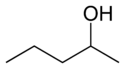
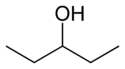
Ved positionsisomeri ændrer en funktionel gruppe eller en anden substituent sin position på en moderstruktur. I nedenstående tabel kan hydroxylgruppen være i tre forskellige positioner på en n-pentankæde for at danne tre forskellige forbindelser.
| Eksempel på positionsisomeri | ||
|
|
|
|
| 1-Pentanol | 2-Pentanol | 3-Pentanol |
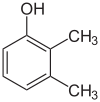
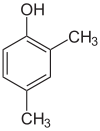
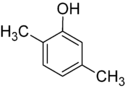
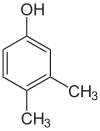
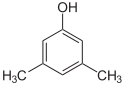
Der findes mange aromatiske isomerer, fordi substituenter kan placeres på forskellige dele af benzenringen. Der findes kun én isomer af phenol eller hydroxybenzen, men kresol eller methylphenol har tre isomerer, hvor den ekstra methylgruppe kan placeres på tre forskellige positioner på ringen. Xylenol har en hydroxylgruppe og to methylgrupper, og der findes i alt 6 isomerer.
| Positionsisomerer af xylenol | ||
|
|
|
|
| 2,3-Xylenol | 2,4-Xylenol | 2,5-Xylenol |
|
|
|
|
| 2,6-Xylenol | 3,4-Xylenol | 3,5-xylenol |
Isomeri af funktionelle grupper
Funktionelle isomerer er en af de strukturelle isomerer. To forbindelser i funktionel isomeri har den samme molekylformel (antallet af hvert atom er det samme, som f.eks. cyclohexan:C
6H
12 og 1-hexen:C
6H
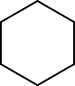
12). Men atomerne er forbundet på andre måder, således at grupperingerne er forskellige. Vi kalder disse grupper af atomer for funktionelle grupper, funktionaliteter eller moieties. En anden måde at sige dette på er, at to forbindelser, der har samme molekylformel, men som har forskellige funktionelle grupper, er funktionelle isomerer.
For eksempel er den kemiske formel for cyclohexan og 1-hexen C6 H12 . Vi kalder dem funktionelle gruppeisomerer, fordi cyclohexan er en cycloalkan og 1-hexen er en alken.
| Eksempel på isomeri af funktionelle grupper | |
|
|
|
| 1-hexen | |
For at to molekyler kan være funktionelle isomerer, skal de indeholde centrale grupper af atomer, der er anbragt på bestemte måder. Nogle af de bedste eksempler stammer fra den organiske kemi. C2 H6 O er en molekylformel. Afhængigt af, hvordan atomerne er anbragt, kan den repræsentere to forskellige forbindelser: dimethylether CH3 -O-CH3 eller ethanol CH3 CH2 -O-H. Dimethylether og ethanol er funktionelle isomerer. Den første er en ether. Funktionaliteten kulstofkæde-oxygen-kulstofkæde kaldes en ether. Det andet er en alkohol. Funktionaliteten kulstofkæde-syrebrint-vandstof kaldes en alkohol.
Hvis funktionaliteterne forbliver de samme, men deres placering ændres, er de strukturelle isomerer ikke funktionelle isomerer. 1-propanol og 2-propanol er strukturelle isomerer, men de er ikke funktionelle isomerer. De er begge alkoholer. Den funktionelle gruppe (kulstofkæden-O-H) er til stede i begge disse forbindelser, men de er ikke ens.
Mens nogle kemikere bruger udtrykkene strukturisomer og funktionel isomer i flæng, er det ikke alle strukturisomerer, der er funktionelle isomerer.
Funktionelle isomerer identificeres oftest i kemi ved hjælp af infrarød spektroskopi. Infrarød stråling svarer til de energier, der primært er forbundet med molekylære vibrationer. Alkoholfunktionaliteten har en meget tydelig vibration kaldet OH-stretch, der skyldes hydrogenbinding. Alle alkoholer i flydende og fast form absorberer infrarød stråling ved bestemte bølgelængder.
Forbindelser med de samme funktionelle grupper vil alle absorbere visse bølgelængder af infrarødt lys på grund af de vibrationer, der er forbundet med disse grupper. Faktisk er det infrarøde spektrum opdelt i to områder. Den første del kaldes området med funktionelle grupper. Dimethylether og ethanol ville have forskellige infrarøde spektrer i den funktionelle gruppe-regionen.
Den anden del af det infrarøde spektrum kaldes fingeraftryksområdet; det er forbundet med de bevægelsesformer, der er tilladt af molekylets symmetri og påvirkes af bindingsenergierne. Fingeraftryksområdet er mere specifikt for en enkelt forbindelse. Selv om 1-propanol og 2-propanol har samme infrarøde spektrum i den funktionelle gruppe, er de forskellige i fingeraftryksområdet.
Funktionelle isomerer er strukturelle isomerer, der har forskellige funktionelle grupper som f.eks. alkohol og ether.
Optælling af isomer
Som et eksempel på isomertælling findes der 7 strukturelle isomerer med molekylformlen C3 H6 O, som hver har forskellige bindingsforbindelser og er luftstabile ved omgivelsestemperatur. Yderligere to strukturelle isomerer er enol-tautomerer af carbonylisomerer, men disse er ikke stabile.
| Molekylær struktur | Smeltepunkt (°C) | Kogepunkt (°C) | Kommentar | |
| Allylalkohol |
| -129 | 97 | |
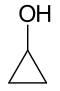
| Cyklopropanol |
| 101-102 | ||
| Propanal |
| - 81 | 48 | Tautomer med (E)-1-propenol og (Z)-1-propenol |
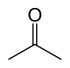
| Acetone |
| - 94.9 | 56.53 | Tautomer med 2-propenol |
| Oxetan |
| - 97 | 48 | |
| Propylenoxid |
| - 112 | 34 | Kan opløses i to enantiomerer |
| Methylvinylether |
| - 122 | 6 |
Søge