Termokemi: Energi, entalpi og varme i kemiske reaktioner
Lær termokemi: forstå energi, entalpi og varme i kemiske reaktioner — beregninger, spontanitet, endoterme/exoterme processer og praktiske eksempler.
Termokemi er studiet af energi og varme i forbindelse med kemiske reaktioner og fysiske omdannelser (fysiske ændringer). Fysiske omdannelser er, når en stoftilstand (f.eks. et fast stof eller en væske) ændres til en anden tilstand. Som eksempler på omdannelser kan nævnes smeltning (når et fast stof bliver til en væske) og kogning (når en væske bliver til en gas).
En reaktion afgiver eller optager energi. En fysisk omdannelse afgiver eller optager også energi. Termokemi ser på disse energiforandringer, især på et systems energiudveksling med omgivelserne. Termokemi er nyttig til at forudsige reaktant- og produktmængder på alle tidspunkter under en given reaktion. Termokemikere gør dette ved hjælp af data, herunder entropibestemmelser. Termokemikere kan fortælle, om en reaktion er spontan eller ikke-spontan, gunstig eller ugunstig.
Endoterme reaktioner optager varme. Exoterme reaktioner afgiver varme. Termokemi kombinerer begreberne i termodynamikken med tanken om energi i form af kemiske bindinger. Den omfatter beregninger af størrelser som varmekapacitet, forbrændingsvarme, dannelsesvarme, entalpi, entropi, fri energi og kalorier.
Kernebegreber i termokemi
- Energi og varme: Varme (q) er energi, der overføres mellem system og omgivelser som følge af temperaturforskel. Energi kan også være bundet i kemiske bindinger og frigives eller optages ved reaktioner.
- Entalpi (ΔH): Entalpi er et mål for et systems varmeindhold ved konstant tryk. For en kemisk reaktion angiver ΔH, om reaktionen er exoterm (ΔH < 0, varme frigives) eller endoterm (ΔH > 0, varme optages).
- Entropi (ΔS): Et mål for uorden eller antallet af mulige mikrostater. Ændringer i entropi påvirker spontaneiteten af processer, især sammen med entalpi i beregningen af fri energi.
- Gibbs fri energi (ΔG): ΔG = ΔH – TΔS (ved konstant tryk og temperatur). En proces er spontan, hvis ΔG < 0, ikke‑spontan hvis ΔG > 0. Dette er den centrale kriterium for spontanitet ved faste temperaturer.
- Kalorimetri: Metoder til at måle varmeudveksling, fx kaffekopkalorimeter (konstant tryk) og bombekalorimeter (konstant volumen).
Vigtige størrelser og enheder
Ofte anvendte enheder i termokemi er joule (J) eller kilojoule (kJ). Historisk er kalorie også brugt. Entalpier angives ofte pr. mol (kJ/mol) eller som samlede reaktionsentalpier. Varmeeffekter kan være ekstensive (afhænger af mængden af stof, fx varme) eller intensive (uafhængige af mængden, fx temperatur).
Hvordan beregnes reaktionsvarme?
Der er flere tilgange:
- Direkte måling: Kalorimetri måler varmeudvekslingen direkte ved en reaktion.
- Hess' lov: Reaktionsentalpien er tilstandsafhængig og ikke afhængig af reaktionsvej. Derfor kan ΔH for en svær reaktion findes ved at kombinere entalpier for enklere trin.
- Dannelsesentalpier: Standarddannelsesentalpien (ΔHf°) for forbindelser bruges til at beregne ΔH° for en reaktion via summen af produkternes ΔHf° minus summen af reaktanternes ΔHf°.
Praktiske eksempler
- Forbrænding af metan (CH4 + 2 O2 → CO2 + 2 H2O) er stærkt exoterm — den frigiver store mængder varme (bruges i fyring og motorer).
- Smeltning af is er endoterm — energi tilføres for at bryde de faste iskrystaller, hvorfor temperaturen kan holde sig ved 0 °C under smeltningen.
Målemetoder og praktiske forhold
Kalorimetre anvendes både i laboratorier og industrien. Ved præcise målinger skal man tage højde for varmetab til omgivelserne, reaktionsvarme ved tryk- eller volumenændringer og varmekapacitet af beholdere. Cp (varmekapacitet ved konstant tryk) og Cv (ved konstant volumen) er vigtige, især når man sammenligner gassers varmeegenskaber.
Tilstands- og vejafhængighed
Entalpi og entropi er tilstandsfunktioner — deres ændringer afhænger kun af begyndelses- og sluttilstand, ikke af den specifikke vej processen tager. Varme og arbejde derimod er vejafhængige størrelser.
Hvorfor er termokemi vigtig?
Termokemi er grundlæggende for kemi, materialeforskning, biokemi (fx forståelse af energifrigivelse i metabolisme), miljøvidenskab (beregning af energibalance i forbrænding og atmosfæriske processer) og tekniske anvendelser som design af reaktorer, varmevekslere og energilagring. Kendskab til entalpi, entropi og fri energi hjælper med at forudsige, styre og optimere kemiske processer.
Yderligere emner
De mere avancerede aspekter omfatter temperaturafhængighed af entalpier (Kirchhoffs lov), beregning af bindingsenergier fra entalpier, og anvendelse af statistisk termodynamik til at forbinde mikroskopiske egenskaber (molekylære energiniveauer) med makroskopiske størrelser som entropi og fri energi.
Samlet giver termokemi redskaber til at kvantificere og forstå energistrømme ved kemiske og fysiske processer — afgørende både teoretisk og praktisk.
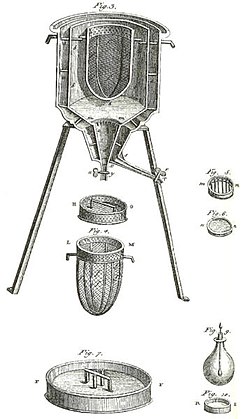
Verdens første is-kalorimeter, der blev brugt i vinteren 1782-83 af Antoine Lavoisier og Pierre-Simon Laplace. Det blev brugt til at finde den varme, der udvikles ved forskellige kemiske ændringer. Disse beregninger var baseret på Joseph Black's tidligere opdagelse af latent varme. Disse eksperimenter var starten på termokemien.
Historie
Termokemi startede med to idéer:
- Lavoisier og Laplace's lov (1780): Energiforandringen ved enhver omdannelse er lig med og modsat energiforandringen ved den omvendte proces.
- Hess' lov (1840): Energiforandringen for enhver omdannelse er den samme, uanset om den foregår i ét eller mange trin.
Disse opdagelser fandt sted før den første termodynamiske lov (1845). De hjalp forskerne med at forstå denne lov.
Edward Diaz og Hess undersøgte den specifikke varme og den latente varme. Joseph Black udviklede begrebet om latente energiforandringer.
Gustav Kirchhoff viste i 1858, at ændringen i reaktionsvarmen er givet ved forskellen i varmekapacitet mellem produkter og reaktanter: ∂ Δ H ∂ T = Δ C p {\displaystyle {{\\partial \Delta H} \over \partiel T}=\Delta C_{p}}} 
Kalorimetri
Måling af varmeændringer kaldes kalorimetri. Den måler varmen ved kemiske reaktioner eller fysiske ændringer. Et kalorimeter, en anordning til kalorimetri, er normalt et lukket kammer.
Kalorimetri består af følgende trin: Kemikere får ændringen til at ske inde i kammeret. Temperaturen i kammeret måles enten ved hjælp af et termometer eller et termoelement. Temperaturen sættes i forhold til tiden for at give en graf. Kemikere bruger grafen til at beregne grundlæggende størrelser.
Moderne kalorimetre har små computere, der måler temperaturen og hurtigt giver de beregnede data. Et eksempel er et DSC-kalorimeter (Differential Scanning Calorimeter).
Systems
Flere termodynamiske definitioner er meget nyttige i termokemi. Et "system" er den specifikke del af universet, der studeres. Alt uden for systemet betragtes som omgivelserne eller miljøet. Et system kan være:
- et isoleret system - når det ikke kan udveksle energi eller stof med omgivelserne, som det er tilfældet med et isoleret bombecalorimeter;
- et lukket system - når det kan udveksle energi, men ikke stof med omgivelserne, som f.eks. en dampkøler;
- et åbent system - når det kan udveksle både stof og energi med omgivelserne, f.eks. en gryde med kogende vand.
Processer
Et system gennemgår en "proces", når en eller flere af dets egenskaber (karakteristika) ændres. En proces er forbundet med en tilstandsændring. En isotermisk (samme temperatur) proces sker, når systemets temperatur forbliver den samme. En isobarisk (samme tryk) proces finder sted, når systemets tryk forbliver det samme. En adiabatisk (ingen varmeudveksling) proces finder sted, når der ikke sker nogen varmeoverførsel.
Relaterede sider
- Vigtige publikationer inden for termokemi
- Isodesmisk reaktion
- Princippet om maksimalt arbejde
- Reaktionskalorimeter
- Thomsen-Berthelot-princippet
- Julius Thomsen
- Termodynamiske databaser for rene stoffer
- Kalorimetri
- Termisk fysik
Spørgsmål og svar
Spørgsmål: Hvad er termokemi?
A: Termokemi er studiet af energi og varme i forbindelse med kemiske reaktioner og fysiske transformationer.
Spørgsmål: Hvad er nogle eksempler på fysiske omdannelser?
A: Eksempler på fysiske omdannelser omfatter smeltning (når et fast stof bliver til væske) og kogning (når en væske bliver til væske).
Spørgsmål: Hvordan hjælper termokemi med at forudsige reaktant- og produktmængder?
Svar: Termokemikere bruger data, herunder entropibestemmelser, til at forudsige reaktant- og produktmængder på alle tidspunkter i en given reaktion.
Spørgsmål: Er endoterme reaktioner gunstige eller ugunstige?
Svar: Endoterme reaktioner er ugunstige.
Spørgsmål: Er exoterme reaktioner gunstige eller ugunstige?
A: Exoterme reaktioner er gunstige.
Spørgsmål: Hvilke begreber kombinerer termokemi?
A: Termokemi kombinerer termodynamikkens begreber med tanken om energi i form af kemiske bindinger.
Spørgsmål: Hvilke typer beregninger foretager termokemikere?
Svar: Termokemikere foretager beregninger som f.eks. varmekapacitet, forbrændingsvarme, dannelsesvarme, enthalpi, entropi, fri energi og kalorier.
Søge