Allotroper af kulstof: diamant, grafit og deres egenskaber
Opdag kulstofs allotroper: diamantens ekstreme hårdhed og glans vs. grafits ledningsevne og industrielle anvendelser — egenskaber, struktur og praktisk brug forklaret.
Der findes flere allotroper af kulstof. Diamant og grafit er de mest kendte. Grafit er en leder, et halvmetal (et grundstof, der delvist er et metal og et ikke-metal, f.eks. sort fosfor og gråt selen). Det kan f.eks. anvendes som materiale i elektroderne i en elektrisk buelampe. Grafit er den mest stabile form for fast kulstof, der nogensinde er opdaget.
Allotrope stoffer er forskellige former af det samme kemiske grundstof. Alle grundstoffer består udelukkende af deres egne atomer. Eventuelle fysiske forskelle skyldes den måde, hvorpå atomerne er sat sammen. Mange grundstoffer udviser allotropi, fordi der er flere måder, hvorpå atomerne kan være forbundet med hinanden. Der er også forskellige måder, hvorpå molekylerne kan arrangeres for at danne større strukturer.
Diamant er en af de bedst kendte allotroper af kulstof. Dens hårdhed og høje spredning af lys gør den velegnet til brug i smykker. Den har også industrielle anvendelsesmuligheder. Diamant er det hårdeste kendte naturlige mineral. Det gør det til et fremragende slibemiddel. En diamant bevarer også sin glans godt. Både diamant og grafit har et ekstremt højt smeltepunkt, hvilket er usædvanligt for et ikke-metallisk element.
Struktur og årsag til forskellige egenskaber
Forskellene mellem diamant og grafit skyldes atomernes bindingsmønstre. I diamant danner hvert kulstofatom fire stærke kovalente bindinger i en tetraedrisk opbygning (hybridiseringstype sp3). Det skaber et tredimensionelt netværk af meget stive bindinger, som giver diamanten dens ekstreme hårdhed og høje elasticitetsmodul.
I grafit er hvert kulstofatom bundet til tre naboer i flade sekskantede ringe (hybridiseringstype sp2). Ringene danner lag, som kan glide let hen over hinanden, fordi bindingerne mellem lagene er svage van der Waals-kræfter. De frie, delokaliserede π-elektroner i lagene gør grafit elektrisk ledende i planen og giver materialet en metallisk glans.
Fysiske og kemiske egenskaber — sammenligning
- Hårdhed: Diamant er det hårdeste naturlige materiale; grafit er blødt og bruges som smøremiddel.
- Elektrisk ledningsevne: Grafit leder elektricitet på grund af delokaliserede elektroner; diamant er elektrisk isolerende i ren form (med undtagelser ved doping).
- Varmekonduktivitet: Diamant har meget høj termisk ledningsevne (gør det nyttigt som varmespreder); grafit leder også varme godt i planretningen.
- Optiske egenskaber: Diamant er gennemsigtig med høj brydningsindeks og høj dispersion (giver "ild" i smykker); grafit er uigennemsigtig og sort/grå.
- Stabilitet: Termodynamisk er grafit den mest stabile form ved standardbetingelser; diamant er kinetisk stabil og omdannes langsomt til grafit uden ekstreme betingelser.
- Reaktivitet: Begge kan oxideres ved høje temperaturer til CO2; diamant er kemisk inert over for mange reagenser under normale betingelser.
Anvendelser
På grund af deres meget forskellige egenskaber bruges diamant og grafit i vidt forskellige sammenhænge:
- Diamant: smykker (ædeldiamant), slibemidler, skæreværktøj og bor, præcisionsslibning, vinduesmateriale i højttryks- og ridsende miljøer, og som varmespreder i elektronik. Syntetiske diamanter fremstilles industrielt ved HPHT (højt tryk, høj temperatur) eller CVD (kemisk dampaflejring).
- Grafit: blyanter (blanding af grafit og ler), elektroder (f.eks. i elektroderne i buelamper), smøremiddel og slidlag, nukleare moderatorer, batterianoder (i lithium-ion-batterier), kompositmaterialer, og som højtemperaturrefraktært materiale.
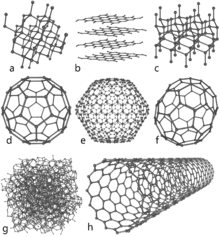
Andre allotroper af kulstof
Kulstof har flere andre former med unikke egenskaber:
- Grafen: et enkelt lag af grafit—en atomtynd plade med ekstraordinær styrke, høj elektrisk og termisk ledningsevne, og stor potentiale i elektronik og sensorer.
- Fullerenes (fx C60): lukkede kugleformede molekyler med interessante elektroniske og kemiske egenskaber, anvendt i forskning og nogle specialmaterialer.
- Kulstofnanorør: cylindriske rør opbygget af grafen—meget stærke, med variable elektriske egenskaber (metaliske eller semiconductive afhængigt af geometri) og stor anvendelse i nanoteknologi.
- Amorft kulstof: uordnet kulstof som sod, koks og visse former af aktivt kul—bruges til filtermaterialer, pigmenter og brændstoffer.
Bemærkninger om termisk stabilitet og faseforandringer
Under atmosfærisk tryk sublimerer carbon ved meget høje temperaturer snarere end at have et tydeligt smeltepunkt (kulstof kan smelte ved ekstremt højt tryk). Overgangen mellem diamant og grafit kræver enten høj temperatur og/eller katalytisk indflydelse eller ændringer i tryk og temperatur, derfor bevarer naturlige diamanter deres struktur gennem geologisk tid selvom grafit er termodynamisk mest stabil ved normale betingelser.
Opsummering
Allotroper af kulstof demonstrerer, hvor meget materialeegenskaber kan variere blot ved at ændre atomernes arrangement. Diamant og grafit er to af de mest markante eksempler: samme element, men vidt forskellige strukturer og anvendelser—fra smykker og præcisionsværktøj til elektroder, smøremidler og avancerede materialer som grafen og nanorør.
størrelse=0.56
Spørgsmål og svar
Spørgsmål: Hvad er allotroper af kulstof?
A: Allotroper af kulstof er forskellige former af det samme kemiske grundstof.
Spørgsmål: Hvilke er de mest berømte allotroper af kulstof?
A: De mest berømte allotroper af kulstof er diamant og grafit.
Sp: Hvad er grafit, og hvilke egenskaber har det?
A: Grafit er et halvmetal og en god leder. Det er også den mest stabile form af fast kulstof, der nogensinde er opdaget.
Spørgsmål: Hvad er allotroper?
Svar: Allotroper er forskellige former af det samme kemiske grundstof.
Sp: Hvorfor udviser forskellige grundstoffer allotropi?
Svar: Mange grundstoffer udviser allotropi, fordi der er flere måder, hvorpå atomerne kan være forbundet med hinanden.
Sp: Hvad er diamant, og hvilke egenskaber har det?
Svar: Diamant er en af de bedst kendte allotroper af kulstof. Dens hårdhed og høje spredning af lys gør den god til brug i smykker. Det er også det hårdeste kendte naturlige mineral.
Spørgsmål: Hvad er smeltepunktet for både diamant og grafit?
Svar: Både diamant og grafit har ekstremt høje smeltepunkter, hvilket er usædvanligt for et ikke-metallisk grundstof.
Søge