Cytochromer: Hvad er de? Funktion, typer og rolle i elektrontransport
Cytochromer: Lær om deres funktion, typer og rolle i elektrontransport og ATP-produktion — essentiel viden om hæmoproteinernes redoxprocesser.
Cytochromer er hæmoproteiner (eller proteiner, der indeholder hæmgrupper). De deltager i dannelsen af ATP via elektrontransport ved at overføre elektroner mellem enzymkomplekser og dermed bidrage til opbygningen af en protongradient over membraner.
Struktur og hæmtyper
Cytochromer har en protein-del og en ikke-proteinsk prostetisk gruppe, hæm, som indeholder et jernatom. Jernet skifter reversibelt mellem oxidationsstaterne Fe2+ og Fe3+ og tillader dermed elektron-overførsel. Der findes flere typer hæm:
- Hæm b (protoporfyrin IX) — almindelig i mange membranbundne cytochromer, f.eks. i kompleks III.
- Hæm c — kovalent bundet til proteinet via thioetherbindinger til cysteinrest(er); findes i bl.a. cytochrom c.
- Hæm a — har specielle kemiske modifikationer (fx formylgruppe og en farnesylderivat) og findes i cytochromoxidase (kompleks IV).
Typer af cytochromer
- Cytochrom a og a3 — dele af cytochrom c oxidase (kompleks IV), vigtige ved ilt-reduktion.
- Cytochrom b — membranbundet, indgår i bl.a. kompleks III (cytochrom bc1-komplekset) og i fotosyntetisk b6f-kompleks.
- Cytochrom c — lille, vandopløselig, perifert bundet protein i mitokondriets mellemliggende rum; transporterer elektroner mellem kompleks III og IV.
- Cytochrom c1 — en komponent af kompleks III, der sammen med cytochrom b danner bc1-komplekset.
- Cytochrom P450 — en stor familie af hæm-thiolat monooxygenaser, vigtige i stofskifte af lægemidler og syntese/omdannelse af lipider og steroider (dog ikke altid omtalt som en klassisk del af respirationskæden).
Funktion i elektrontransportkæden
Cytochromer fungerer som elektronbærere i respirationskæden i mitokondrier, i fotosyntesens elektrontransport samt i bakterielle respirationssystemer. De overfører elektroner mellem komplekser i kæden, og nogle komplekser bruger denne elektrontransport til samtidig at pumpe protoner over en membran. Denne protongradient driver ATP-syntase og dermed produktion af ATP.
Eksempler på roller:
- Kompleks III (cytochrom bc1) overfører elektroner fra ubikinon til cytochrom c og bidrager til protonpumping via Q-cyklussen.
- Cytochrom c transporterer elektroner i opløst form mellem kompleks III og kompleks IV.
- Kompleks IV (cytochrom c oxidase) modtager elektroner fra cytochrom c og katalyserer den endelige reduktion af O2 til H2O; denne reaktion er også forbundet med protonpumping.
Biokemiske og medicinske aspekter
Udover deres centrale rolle i energimetabolisme har cytochromer flere andre betydninger:
- Apoptose: Frigivelse af mitokondrie-cytochrom c til cytosol er et vigtigt signal i den indre apoptotiske vej, hvor det aktiverer caspaser og fører til programmeret celledød.
- Farmakologi og toksikologi: Cytochrom P450-enzymer metaboliserer mange lægemidler og xenobiotika; hæmning eller induktion af disse kan ændre lægemiddelvirkning og bivirkninger.
- Sygdomme: Mutationer i cytochrom-relaterede proteiner eller i mitokondrielle gener, som påvirker elektrontransporten, kan give anledning til mitokondrie-sygdomme med nedsat energiproduktion.
- Bioteknologi: Cytochromer bruges i biosensorer og i forskning til at forstå elektrontransport og redoxkemi; P450-isoformer anvendes også i industrien til biotransformation.
Spektroskopiske egenskaber og anvendelse i forskning
Hæmgruppens konjugerede ringstruktur giver stærke absorptionsegenskaber i det synlige område, hvilket gør cytochromer lette at følge med spektroskopi. Reduktionstilstand (Fe2+ vs. Fe3+) ændrer absorptionsspektret, og mange cytochromer har et karakteristisk alfa-bånd i det røde område (f.eks. cytochrom c omkring ~550 nm i reduceret form). Sådanne egenskaber bruges til at bestemme redox-tilstand, kinetik og binding af ligander i undersøgelser.
Praktisk opsummering
- Hvad: Hæmholdige proteiner, der kan optage og afgive elektroner.
- Hvorfor: Nødvendige for effektiv elektrontransport og opbygning af den protongradient, der driver ATP-syntese.
- Hvor: I mitokondrier, kloroplaster, bakterier og i en række enzymsystemer (fx P450).
Bemærk: Cytochromers funktion og struktur er et stort forskningsområde; ovenstående er en oversigt over de vigtigste principper og eksempler.
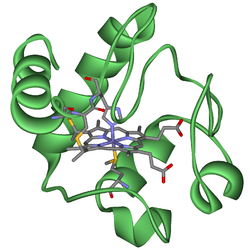
Cytokrom c med hæm c.
Historie
Cytokromer blev beskrevet i 1884 som respirationspigmenter. De omfatter (hæmoglobin, myoglobin, hæmocyanin, hæmoerythrin og chlorocruorin). I 1920'erne genopdagede Keilin disse respirationspigmenter. Han kaldte dem cytokromer eller "cellepigmenter" og klassificerede dem som hæmproteiner.
Typer
Der findes flere slags cytokromer, som kan adskilles ved spektroskopi. Der er tre typer cytokromer, som adskilles på grund af deres prostetiske grupper. I mitokondrier og kloroplaster er disse cytokromer ofte kombineret i elektrontransport og relaterede metaboliske veje.
Spørgsmål og svar
Q: Hvad er cytokromer?
A: Cytokromer er hæmoproteiner eller proteiner, der indeholder hæmgrupper.
Q: Hvad gør cytokromer?
A: De laver ATP ved elektrontransport.
Q: Hvordan findes cytokromer?
A: De findes enten som enkeltstående (monomere) proteiner eller som en del af større enzymkomplekser, der katalyserer redoxreaktioner.
Q: Hvad gør hæmgruppen i cytokromer?
A: Hæmgruppen udfører redoxreaktionerne.
Q: Hvad er redoxreaktionernes natur?
A: Redoxreaktioner involverer overførsel af elektroner.
Q: Kan du nævne et eksempel på et enkelt cytokrom-protein?
A: Ja, cytokrom c er et eksempel på et enkelt cytokrom-protein.
Q: Hvilken type kemiske reaktioner involverer redoxreaktioner?
A: Redoxreaktioner omfatter alle kemiske reaktioner, hvor atomernes oxidationstrin ændres.
Søge