Isolobal analogi: Definition og rolle i organometallisk kemi
Lær isolobal analogi: definition, Hoffmanns teori, anvendelse i organometallisk kemi og forudsigelse af bindinger og reaktivitet — klar, illustrativ gennemgang.
Det isolobale princip (også kendt som isolobal analogi) er en metode til at forudsige bindingsegenskaberne for organometalliske forbindelser. I organometalkemi vedrører det strukturen af organiske ligander, der kan binde til uorganiske molekylfragmenter. Roald Hoffmann beskrev molekylære fragmenter som isolobale, "hvis antallet, symmetriegenskaberne, den omtrentlige energi og formen af grænseorbitalerne og antallet af elektroner i dem er ens - ikke identiske, men ens". Man kan forudsige bindingen og reaktiviteten af et mindre kendt stykke ud fra et bedre kendt stykke, hvis de to molekylære fragmenter har lignende grænseorbitaler, det højest besatte molekylære orbital (HOMO) og det laveste ubesatte molekylære orbital (LUMO). Isolobalforbindelser er analoger til isoelektroniske forbindelser, der har samme antal valenselektroner og samme struktur. En grafisk fremstilling af isolobale strukturer, hvor de isolobale par er forbundet ved hjælp af en pil med dobbelthovedet pil med en halv orbital under, findes i figur 1.
For sit arbejde med den isolobale analogi modtog Hoffmann Nobelprisen i kemi i 1981, som han delte med Kenichi Fukui. I sin Nobelprisforelæsning understregede Hoffmann, at den isolobale analogi er en nyttig, men enkel model. Den fejler dog i visse tilfælde.
Hvad betyder "isolobal" i praksis?
Et fragment beskrives som isolobal med et andet fragment, når de to har tilsvarende:
- antal frontier‑orbitaler (de orbitaler, som deltager i bindinger),
- symmetri og rumlig form af disse orbitaler,
- omtrent samme energi for de relevante orbitaler, og
- samme antal elektroner i disse frontier‑orbitaler.
Denne ækvivalens gør det muligt at sammenligne, hvordan to tilsyneladende forskellige fragmenter vil binde til hinanden eller til en tredje partner. Isolobalitet er altså et værktøj til at overføre kemisk intuition fra velkendte organiske fragmenter til ofte mere komplekse metal‑ eller clusterfragmenter.
Anvendelser i organometalkemi
- Forudsigelse af struktur: Isolobal analogi bruges til at forudsige geometrier og forbindelsesformer i metal‑organiske kompleks og metal‑klynger ved at sammenligne med tilsvarende organiske systemer.
- Design af nye forbindelser: Kemikere kan udskifte et organisk fragment med et isolobalt metalfragment for at skabe nye molekyler med lignende bindingsmønstre eller elektroniske egenskaber.
- Rationalisering af reaktivitet: Ved at kende HOMO/LUMO‑karakteren for et isolobalt par kan man forudsige hvilke reaktioner fragmenterne vil deltage i, og hvordan elektronparfordelingen vil ændre sig under en reaktion.
- Forklaring af metal‑metal bindinger og clusteropførsel: Isolobalitet hjælper med at forstå, hvordan metalatomer eller metalfragmenter kan kombinere for at danne klynger, og hvorfor bestemte bindingsmønstre foretrækkes.
Grundlæggende fremgangsmåde
I praksis anvendes isolobal analogi typisk sammen med enkel orbital‑ og elektronoptælling. Man undersøger et fragments frontier‑orbitaler og sammenligner:
- antal orbitaler til rådighed for binding,
- om disse orbitaler er singly eller doubly occupied,
- symmetri og orientering (hvor orbitalerne peger), og
- energiniveauer (om orbitalerne er høje eller lave sammenlignet med potentielle partnere).
Ud fra denne sammenligning kan man forudsige, om to fragmenter vil binde sig via en σ‑binding, π‑interaktion, eller danne mere komplekse multi‑center‑bindinger.
Eksempler (konceptuelle)
- Et organisk radikal med én uparret elektron i en enkelt orienteret orbital er isolobalt med et metalfragment, der har én uprakt elektron i en tilsvarende orientation—de kan danne en σ‑binding ved at parre disse orbitaler.
- Et dobbeltbundet organisk fragment (med to frontier‑orbitaler) kan ofte være isolobalt med et metalfragment, der tilbyder to egnede orbitaler til binding, hvilket forklarer lignende bindingsvinkler eller reaktivitet.
(Disse eksempler er konceptuelle; konkrete eksempler kræver altid kontrol af orbitalenergi, spintilstand og molekylær geometri ved hjælp af spektroskopi eller beregningskemi.)
Begrænsninger og forholdsregler
Selvom isolobal analogi er et stærkt heuristisk værktøj, har metoden klare begrænsninger:
- Energi‑forskelle: Selv om orbitalernes form kan ligne, kan deres energier være forskellige, hvilket påvirker bindingens styrke og reaktivitet.
- Elektronegativitet og polarisering: Metal‑organiske fragmenter kan have betydelig polarisering sammenlignet med rene kulstoffragmer, hvilket ændrer bindingskarakteren.
- Spintilstande: Forskellige spinmultipliciteter (singlet vs. triplet osv.) kan gøre to tilsyneladende isolobale fragmenter ikke‑udskiftelige i praksis.
- Steriske effekter og ligandfelt: Større ligander eller koordinationsmiljø omkring metalcentre kan forhindre de forventede bindingsmønstre.
- Relativistiske effekter: Tunge metaller påvirkes af relativistiske effekter, som kan ændre orbitalenergi og —form i forhold til lette‑atom‑modeller.
Praktisk brug i moderne kemi
Isolobal analogi kombineres ofte med kvantemekaniske beregninger (fx DFT) og spektralanalyse for at bekræfte antagelser om orbitalform og energi. Modellen bruges stadig aktivt som et pædagogisk redskab og som en hurtig måde at tænke over nye målstrukturer i syntese‑ og katalyseforskning.
Konklusion: Den isolobale analogi er et enkelt, men kraftfuldt koncept til at forbinde organisk og metal‑kemi gennem orbitalbaseret tænkning. Den giver intuition og muligheder for at designe nye organometalliske forbindelser, men kræver supplerende eksperimentel og beregningsmæssig kontrol for at håndtere sine begrænsninger.
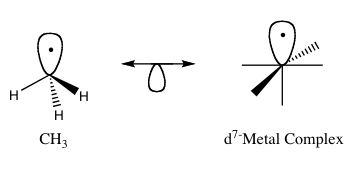
Figur 1: Grundlæggende eksempel på den isolobale analogi.
Spørgsmål og svar
Spørgsmål: Hvad er det isolobale princip?
A: Det isolobale princip (også kendt som isolobal analogi) er en måde at forudsige bindingsegenskaberne for organometalliske forbindelser på. Det relaterer strukturen af organiske ligander, der kan binde til uorganiske molekylære fragmenter, ved at sammenligne deres højeste besatte molekylære orbital (HOMO) og laveste ubesatte molekylære orbital (LUMO).
Sp: Hvem foreslog det isolobale princip?
Svar: Roald Hoffmann foreslog det isolobale princip.
Spørgsmål: Hvordan hænger det sammen med isoelektroniske forbindelser?
A: Isolobale forbindelser er analoger til isoelektroniske forbindelser, der har det samme antal valenselektroner og den samme struktur.
Spørgsmål: Hvad modtog Hoffmann for sit arbejde med dette koncept?
Svar: For sit arbejde med den isolobale analogi fik Hoffmann i 1981 Nobelprisen i kemi, som han delte med Kenichi Fukui.
Spørgsmål: Hvordan beskrev Hoffmann molekylære fragmenter?
A: Hoffmann beskrev molekylfragmenter som isolobale, "hvis antallet, symmetriegenskaberne, den omtrentlige energi og formen af grænseorbitalerne og antallet af elektroner i dem er ens - ikke identiske, men ens".
Spørgsmål: Hvordan kan man bruge denne model til at forudsige binding og reaktivitet?
Svar: Man kan forudsige binding og reaktivitet for mindre kendte dele ud fra bedre kendte dele, hvis de har lignende grænseorbitaler.
Spørgsmål: Virker denne model altid korrekt?
Svar: Nej, den fejler i visse tilfælde.
Søge