Supramolekylær kemi: Definition, ikke-kovalente interaktioner og eksempler
Forstå supramolekylær kemi: definition, ikke-kovalente interaktioner (fx hydrogenbindinger) og eksempler. Se hvordan naturens kræfter styrer struktur, funktion og nye materialer.
Supramolekylær kemi er et område inden for kemi, hvor man studerer forholdet mellem og sammenkoblingen af molekyler til større systemer. Den fokuserer på kemiske systemer, der består af et diskret antal sammensatte molekylære underenheder eller komponenter. Undersøgelsen af ikke‑kovalente interaktioner er afgørende for forståelsen af mange biologiske processer, fra cellestruktur til syn, der er afhængige af disse kræfter for struktur og funktion. Biologiske systemer er ofte inspirationskilden til supramolekylær forskning.
Hvad menes med ikke‑kovalente interaktioner?
Ikke‑kovalente interaktioner er de relativt svage, reversible kræfter, der får molekyler til at genkende hinanden og holde sammen uden at danne egentlige kovalente bindinger. Når mange af disse kræfter virker samtidigt, kan de tilsammen blive meget stærke. Centrale typer omfatter:
- Hydrogenbindinger – f.eks. mellem basepar i DNA, som stabiliserer dobbelthelixen.
- Elektrostatiske interaktioner – tiltrækning/ frastødning mellem ladede grupper (ion‑ion, ion‑dipol).
- Dipol‑dipol og inducerede dipol‑kræfter – herunder van der Waals-kræfter (London-dispersion).
- π–π‑stabling og kation–π – interaktioner mellem aromatiske ringe eller mellem kationer og aromatiske systemer.
- Hydrofobe effekter – upolære dele samler sig i vand (driver dannelse af miceller og cellemembraner).
- Koordinering mellem metaller og ligander – ofte udnyttet i supramolekylært design til styring af form og geometri.
Hvorfor er de vigtige? De styrer blandt andet proteins foldning, enzymers genkendelse af substrater, transport af små molekyler i kroppen, membraners struktur og lyssansning i øjet. I materialekemi gør de det muligt at bygge komplekse arkitekturer, der kan reagere på lys, pH eller elektriske signaler.
Nøglebegreber i supramolekylær kemi
- Molekylær genkendelse: En vært (host) binder selektivt en gæst (guest) via komplementær form, ladning og funktionelle grupper – som en nøgle i en lås.
- Værts–gæst‑komplekser: Kroneser (crown ethers), cyclodextriner og cucurbituriler kan indkapsle ioner eller små molekyler og ændre deres opløselighed, reaktivitet og stabilitet.
- Selvorganisering og selv‑samling: Enheder sætter sig spontant sammen til ordnede strukturer (miceller, vesikler, fiberstrukturer, krystaller) styret af de ovennævnte kræfter.
- Dynamik og reversibilitet: Bindinger dannes og brydes igen, hvilket muliggør adaptiv adfærd, fejl‑korrektion og stimuli‑respons.
- Supramolekylære maskiner: Mekanisk sammenlåste molekyler som rotaxaner og katenaner, hvor dele kan bevæge sig kontrolleret i forhold til hinanden.
Illustrative eksempler
- DNA: Stabiliseres af hydrogenbindinger mellem basepar og π–π‑stabling mellem baser.
- Proteiner og enzymer: Foldes og binder substrater gennem et netværk af hydrogenbindinger, hydrofobe effekter og elektrostatiske kræfter.
- Biologiske membraner: Fosfolipider danner dobbeltlag via hydrofobe effekter; kollektive ikke‑kovalente interaktioner giver fleksibilitet og selektiv transport.
- Kroneser og ionkompleksation: En 18‑krone‑6 ring binder selektivt K⁺ og muliggør ekstraktion gennem opløsningsmiddellag eller faseoverførsel i syntese.
- Cyclodextriner: “Molekylære kopper”, der indkapsler gæster; anvendes til at forbedre lægemidlers opløselighed og stabilitet.
- Rotaxaner og katenaner: Danner basis for kunstige molekylære maskiner og kontrolleret bevægelse på nanoskala.
Design, måling og styring
- Designprincipper: Balancen mellem enthalpi/entropi, opløsningsmiddel, temperatur, ionstyrke og pH bestemmer bindingsstyrke og selektivitet.
- Støkiometri og bindingstyrke: Simple modeller (1:1, 1:2) beskriver komplekser; associationkonstanter kvantificerer hvor stærkt værten binder gæsten.
- Eksperimentelle metoder: NMR‑titrering, UV‑Vis og fluorescensspektroskopi, isotermisk titreringskalorimetri (ITC), massespektrometri, røntgenkrystallografi og mikroskopi (AFM/STM).
- Stimuli‑responsive systemer: Lys, redox, pH eller temperatur kan tænde/slukke binding og udløse kontrolleret frigivelse eller bevægelse.
Anvendelser
- Lægemiddellevering: Værts–gæst‑komplekser og miceller transporterer aktive stoffer og frigiver dem målrettet.
- Sensing og diagnostik: Selektive værter omsætter binding til et optisk eller elektrisk signal for at detektere ioner, eksplosiver eller biomarkører.
- Materialer: Selvreparerende polymerer, geléer og porøse netværk designet via ikke‑kovalente knudepunkter.
- Katalyse: Supramolekylære “lommer” orienterer reaktanter korrekt, hvilket kan øge reaktionshastighed og selektivitet – inspireret af enzymer.
- Miljø og energi: Selektiv fangst af forurenende stoffer, separering af gasser og organisering af fotoniske/elektroniske komponenter.
Kort fortalt: Supramolekylær kemi undersøger, hvordan svage, reversible kræfter mellem molekyler skaber ordnede, funktionelle strukturer. Denne forståelse forklarer naturens komplekse systemer og gør det muligt at bygge nye materialer, sensorer og lægemiddelteknologier ved at “programmere” interaktioner mellem molekylære byggesten.
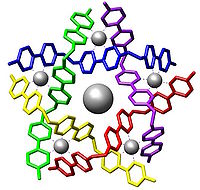
Et eksempel på en supramolekylær samling.
![Supramolekylært kompleks af en chloridion, cucurbit[5]uril og cucurbit[10]uril.](https://alegsaonline.com/image/200px-Cucurbituril_gyroscope_AngewChemIntEd_2002_v41_p275_hires.png)
Supramolekylært kompleks af en chloridion, cucurbit[5]uril og cucurbit[10]uril.
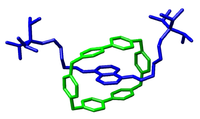
Et eksempel på en mekanisk sammenkoblet molekylær arkitektur, i dette tilfælde en rotaxan.
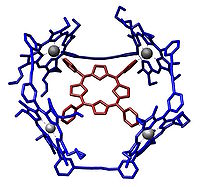
Et eksempel på en vært-gæst-kemi.
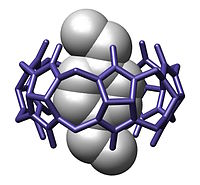
vært-gæst-kompleks med et p-xylylendiammonium bundet i et cucurbituril.
Intramolekylær selvmontering af en foldamer.
Relaterede sider
Søge