Termodynamikkens anden lov — Entropi: Definition og forklaring
Klar og simpel forklaring på termodynamikkens anden lov og entropi: definition, principper, eksempler og betydning for energi og uorden.
Termodynamikkens anden lov siger, at når energi skifter fra en form til en anden form, eller når stof bevæger sig frit, øges entropien (uorden) i et lukket system.
Forskelle i temperatur, tryk og massefylde har en tendens til at udjævne sig horisontalt efter et stykke tid. På grund af tyngdekraften udjævnes massefylde og tryk ikke vertikalt. Tætheden og trykket vil være større i bunden end i toppen.
Entropi er et mål for spredningen af stof og energi til alle de steder, hvor de har adgang.
Den mest almindelige formulering af termodynamikkens anden lov skyldes i det væsentlige Rudolf Clausius:
Med andre ord forsøger alting at opretholde den samme temperatur over tid.
Der findes mange forskellige udtryk for den anden lov, som alle har samme betydning, men som alle bruger forskellige udtryk. Et andet udsagn af Clausius er:
Varme kan ikke i sig selv passere fra et koldere til et varmere legeme.
En tilsvarende udtalelse fra Lord Kelvin er:
En omdannelse, hvis eneste slutresultat er at omdanne varme, der udvindes fra en kilde med konstant temperatur, til arbejde, er umulig.
Den anden lov gælder kun for store systemer. Den anden lov handler om den sandsynlige adfærd i et system, hvor der ikke kommer energi eller stof ind eller ud. Jo større systemet er, jo mere sandsynligt er det, at den anden lov vil være sand.
Hvad menes med entropi?
Entropi måler, hvor mange måder et system kan arrangeres på, uden at de makroskopiske størrelser (tryk, volumen, temperatur) ændrer sig. I den statistiske fortolkning giver Boltzmanns formel sammenhæng mellem entropi og antallet af tilgængelige mikrotilstande W:
S = k·ln W, hvor k er Boltzmanns konstant (≈ 1,38·10⁻²³ J/K). Entropi måles i enheden J/K.
På et intuitivt plan kan man tænke på entropi som et mål for spredning: varmeenergi, partikler eller information, der bliver fordelt over flere tilstande eller steder, øger entropien.
Matematisk og praktisk anvendelse
I termodynamikken skrives ændringen i entropi for en reversibel varmeoverførsel som
dS = δQ_rev / T,
hvor δQ_rev er den reversible varme, og T er den absolutte temperatur. For irreversible processer er den samlede entropi i et isoleret system stigende eller konstant; den kan aldrig falde:
ΔS_tot ≥ 0.
Reversible og irreversible processer
- Reversible proces: En idealiseret proces, hvor systemet hele tiden er i ligevægt, og hvor entropiændringen kun skyldes varmeudveksling (ingen intern produktion af entropi).
- Irreversibel proces: Reelle processer (f.eks. friktion, fri ekspansion, varmeledning) producerer entropi internt — det er derfor, entropien stiger.
Praktiske eksempler
- To legemer med forskellig temperatur, der bringes i kontakt: varme strømmer fra det varmere til det koldere legeme, og den samlede entropi stiger.
- Blanding af to gasser: når gasser blandes spontant, øges antallet af tilgængelige mikrotilstande, og entropien stiger.
- Drevne maskiner og varmemotorer: anden lov sætter en øvre grænse for effektiviteten (Carnotsætningen) — man kan ikke omdanne al varme til arbejde.
Lokale entropifald og totalentropi
Entropi kan falde lokalt (fx når en fryser afkøler indholdet), men det sker kun ved, at entropien andre steder i omgivelserne øges endnu mere. Derfor kan totalentropien for et isoleret system ikke falde.
Begrænsninger og statistisk karakter
Den anden lov er statistisk: for mikroskopiske systemer (få partikler) kan sandsynlige fluktuationer føre til midlertidige, lokale fald i entropi. For makroskopiske systemer med ~10²³ partikler er sådanne fluktuationer praktisk talt umulige at observere, og loven fremstår som deterministisk.
Forbindelse til information
Der er en tæt relation mellem termodynamisk entropi og informationsbegrebet (Shannons entropi). Begge måler usikkerhed eller manglende information om et systems præcise tilstand. Dette forhold bruges aktivt i statistisk fysik og i teorien om termodynamik af beregning (f.eks. Landauers princip).
Sammenfatning
Termodynamikkens anden lov siger i praksis, at energiens og stoffets tendens til at sprede sig fører til en øget entropi i et isoleret system. Udtalelserne af Clausius og Kelvin angiver to ækvivalente måder at formulere denne begrænsning på: varme går spontant fra varmt til koldt, og man kan ikke fuldstændigt omdanne varme til mekanisk arbejde uden tab. Forståelsen af entropi både som et statistisk mål for mikrotilstande og som et termodynamisk mål for energispredning gør anden lov til et centralt koncept i fysik, kemi og ingeniørvidenskab.
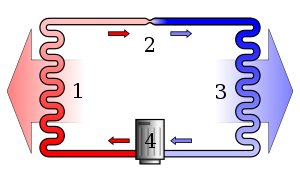
Et simpelt stiliseret diagram af en varmepumpes dampkompressionskølecyklus: 1) kondensator, 2) ekspansionsventil, 3) fordamper, 4) kompressor.
Oversigt
Generelt set siger den anden lov, at temperaturforskelle mellem systemer, der er i kontakt med hinanden, har tendens til at udjævne sig, og at der kan opnås arbejde ud fra disse uligevægtsforskelle, men at der sker tab af termisk energi, når der udføres arbejde, og entropien stiger. Tryk-, massefylde- og temperaturforskelle i et isoleret system har alle en tendens til at udligne sig, hvis de får mulighed for det; massefylde og tryk, men ikke temperatur, påvirkes af tyngdekraften. En varmemotor er en mekanisk anordning, der leverer nyttigt arbejde ud fra forskellen i temperatur mellem to legemer.
Citater
| “ | Loven om, at entropien altid stiger, har efter min mening den højeste position blandt naturlovene. Hvis nogen påpeger over for Dem, at Deres yndlingsteori om universet er i uoverensstemmelse med Maxwells ligninger - så er Maxwells ligninger ikke så meget desto værre. Hvis det viser sig, at den modsiges af observationer - ja, eksperimentalisterne laver nogle gange fejl. Men hvis det viser sig, at Deres teori er i strid med termodynamikkens anden lov, kan jeg ikke give Dem noget håb; der er intet andet for Dem end at bryde sammen i dybeste ydmygelse. | ” |
--Sir Arthur Stanley Eddington, The Nature of the Physical World (1927)
| “ | Tendensen til at entropien stiger i isolerede systemer er udtrykt i termodynamikkens anden lov - måske den mest pessimistiske og amoralske formulering i al menneskelig tænkning. | ” |
--Greg Hill og Kerry Thornley, Principia Discordia (1965)
| “ | Der findes næsten lige så mange formuleringer af den anden lov, som der har været diskussioner om den. | ” |
--Filosof/fysiker P.W. Bridgman, (1941)
Diverse
- Flanders og Swann lavede en musikalsk fortolkning af den anden termodynamiske lov, kaldet "First and Second Law".
- Økonomen Nicholas Georgescu-Roegen viste betydningen af entropiloven inden for økonomi (se hans værk The Entropy Law and the Economic Process (1971), Harvard University Press).
Spørgsmål og svar
Q: Hvad er termodynamikkens anden lov?
A: Termodynamikkens anden lov siger, at når energi skifter fra en form til en anden, eller stof bevæger sig frit, øges entropien (uordenen) i et lukket system.
Q: Hvad har tendens til at udjævne sig horisontalt over tid?
A: Forskelle i temperatur, tryk og massefylde har en tendens til at udjævne sig horisontalt efter et stykke tid.
Q: Hvorfor udjævnes densitet og tryk ikke vertikalt?
A: På grund af tyngdekraften udligner densitet og tryk sig ikke vertikalt. Tætheden og trykket på bunden vil være større end på toppen.
Q: Hvad er entropi?
A: Entropi er et mål for spredning af stof og energi til alle steder, hvor de har adgang.
Q: Hvad er den mest almindelige formulering af termodynamikkens anden hovedsætning?
A: Den mest almindelige formulering af termodynamikkens anden hovedsætning skyldes Rudolf Clausius: Alt forsøger at opretholde den samme temperatur over tid.
Q: Hvad er et andet udsagn af Clausius om termodynamikkens anden hovedsætning?
A: Et andet udsagn af Clausius er, at varme ikke af sig selv kan passere fra et koldere til et varmere legeme.
Q: Hvilken slags system gælder termodynamikkens anden hovedsætning for?
A: Termodynamikkens anden lov gælder kun for store systemer, hvor ingen energi eller stof kommer ind eller ud. Jo større systemet er, jo mere sandsynligt er det, at den anden lov er sand.
Søge