Brint
Brint har tre hovedisotoper: protium (1H), deuterium (2H) og tritium (3H). Disse isotoper dannes naturligt i naturen. Protium og deuterium er stabile. Tritium er radioaktivt og har en halveringstid på ca. 12 år. Forskere har skabt fire andre brintisotoper (4H til7 H), men disse isotoper er meget ustabile og findes ikke naturligt.
De vigtigste isotoper af brint er unikke, fordi de er de eneste isotoper, der har et navn. Disse navne er stadig i brug i dag. Deuterium og tritium får undertiden deres egne symboler, D og T. Den Internationale Union for Ren og Anvendt Kemi bryder sig dog ikke særlig meget om disse navne, selv om de ofte anvendes. Der er andre isotoper, som havde deres egne navne, da forskerne studerede radioaktivitet. Men deres navne bruges ikke længere i dag.
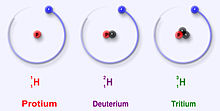
De tre mest stabile isotoper af brint
Protium (hydrogen-1)
Protium er den mest almindelige isotop af brint. Den udgør mere end 99,98 % af al brint i universet. Den hedder protium, fordi dens kerne kun har én proton. Protium har en atommasse på 1,00782504(7) u. Symbolet for protium er 1H.Protiums proton er aldrig henfaldet i en observation, så forskerne mener, at protium er en stabil isotop. Nye teorier inden for partikelfysikken forudsiger, at en proton kan henfalde, men at dette henfald er meget langsomt. Det siges, at protonens halveringstid er på 1036 år. Hvis protonens henfald er sandt, så er alle andre kerner, der siges at være stabile, i virkeligheden kun observeret stabile, dvs. de ser ud til at være stabile. Nylige eksperimenter har vist, at hvis protonens henfald finder sted, vil det have en halveringstid på 6,6 × 1033 år.
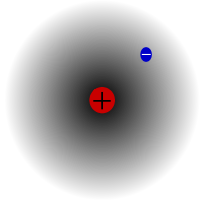
Protium, den mest almindelige isotop af brint. Den er speciel, fordi den er den eneste isotop, der ikke har nogen neutron.
Deuterium (hydrogen-2)
Deuterium, eller 2H eller undertiden D, er en anden stabil isotop af brint. Isotopen har én proton og én neutron. Den udgør ca. 0,0026 - 0,0184 % af alle brintatomer på Jorden. Deuterium er mindre i brintgas på Jorden og er mere i havvand (0,015 % eller 150 ppm). Deuterium er ikke radioaktivt, og det vil ikke skade levende væsener. Deuterium kan også danne vandmolekyler. Vand, der indeholder deuterium i stedet for protium, kaldes tungt vand.
Tritium (hydrogen-3)
Tritium (3H) er den mest stabile radioisotop af brint. Det vil sige, at af alle radioaktive isotoper af brint er tritium den mindst radioaktive. Den har en proton og 2 neutroner i sin kerne. Tritium henfalder gennem beta minus henfald og ændres til helium-3. Det har en halveringstid på 12,32 år.Tritium dannes naturligt ved samspillet mellem gasserne i den øvre atmosfære og kosmisk stråling. Det dannes også under kernevåbenforsøg. Tritium og deuterium anvendes i D-T-kernefusion i stjerner til at afgive en masse energi.
Spørgsmål og svar
Q: Hvor mange hovedisotoper af hydrogen er der?
A: Der er tre hovedisotoper af brint: protium, deuterium og tritium.
Q: Er protium og deuterium stabile isotoper?
A: Ja, protium og deuterium er stabile isotoper.
Q: Hvad er halveringstiden for tritium?
A: Tritium er radioaktivt og har en halveringstid på ca. 12 år.
Q: Hvor mange andre hydrogenisotoper har forskere skabt?
A: Forskere har skabt fire andre hydrogenisotoper: 4H til 7H.
Q: Findes disse fire ekstra hydrogenisotoper i naturen?
A: Nej, disse isotoper er meget ustabile og findes ikke naturligt.
Q: Hvad gør de vigtigste isotoper af brint unikke?
A: Hovedisotoperne af hydrogen er unikke, fordi de er de eneste isotoper, der har et navn.
Q: Har deuterium og tritium deres egne symboler?
A: Ja, deuterium og tritium får nogle gange deres egne symboler: D og T. International Union of Pure and Applied Chemistry bryder sig dog ikke så meget om disse navne, selvom de ofte bruges.
Søge