Döbereiners lampe: Hydrogenlighterens virkemåde og historie (1823)
Döbereiners lampe: Historien bag hydrogenlighteren fra 1823 og dens kemiske virkemåde — opdag opfindelsen, reaktionen og platinets rolle.
Döbereiners lampe er en af de første lightere og regnes som et af de tidligste praktiske eksempler på katalytisk antændelse. Den blev udviklet i 1823 af den tyske kemiker Johann Wolfgang Döbereiner (1780–1849). Tænderen blev produceret kommercielt indtil omkring 1880. I dag har blandt andre Heidelberg Slot og Deutsches Museum (tysk museum) stadig originale Döbereiner-lamper udstillet.
Hvordan den virker
Lighteren udnytter en simpel kemisk proces til at frembringe brintgas, som derefter antændes katalytisk. Hoveddele i en typisk lampe er en glascylinder (mærket a på mange samtidige illustrationer), en åben flaske med zinkstykker (b) og en ventil i toppen, samt et håndtag (f) til at styre kontakten mellem syre og zink. I glascylinderen findes der svovlsyre, og i flasken er der zink. Når håndtaget aktiveres, lukkes eller åbnes en kanal, så svovlsyren kan løbe ind i flasken og komme i kontakt med zinken.
- Når håndtaget (f) åbnes, strømmer svovlsyren ned og møder zinken.
- Der dannes brintgas ved syre-zink-reaktionen, og brinten stiger op mod ventilen.
- Ved ventilen er der en lille mængde platin (ofte som porøst platin eller platinbelægning), som brintgassen passerer over.
- På grund af platinets katalytiske virkning reagerer brintgassen med ilt fra luften og antænder uden flint eller åben tændstik, hvorved der dannes en lille låge.
Kemien bag processen
Den første reaktion er zinkens reaktion med svovlsyre, som frigiver brint:
Z n + H 2 S O 4 ⟶ Z n 2 + + + S O 4 2 2 - + H 2 ↑ {\displaystyle \mathrm {Zn+H_{2}SO_{4}\longrightarrow Zn^{2+}+SO_{4}^{2-}+H_{2}\uparrow } }
Den dannede brint blandes med atmosfærisk ilt og antændes via platinets katalyse, hvorefter den exotermiske forbrændingsreaktion danner vand:
2 H 2 + O 2 ⟶ 2 H 2 O {\displaystyle \mathrm {2\ H_{2}+O_{2}\longrightarrow 2\ H_{2}O} }
Platinets rolle er at sænke aktiveringsenergien for reaktionen mellem brintgassen og luftens ilt. Når brintmolekylerne adsorberes på platinoverfladen, kan de lettere reagere med ilt, varme udvikles lokalt, og gassen antændes uden ekstern gnist.
Stop af reaktionen og sikkerhed
For at stoppe flammen lukkes flasken ved at slippe håndtaget, så svovlsyren trækkes væk fra zinken. Brintproduktionen ophører, og den resterende brint i systemet opbruges eller forsvinder uden at blive ved med at brænde. I praksis gjorde man ofte brug af en ventilmekanisme, så gassen ikke kunne strømme frit, når tændingen skulle standses.
Selvom Döbereiners lampe var en imponerende og praktisk opfindelse for sin tid, indebærer princippet nogle sikkerhedsrisici:
- Fri brint er meget brandfarlig og kan danne eksplosive blandinger med luft.
- Oplag af svovlsyre og korrosive reaktioner med zink kræver omhyggelig håndtering og tæt konstruktion for at undgå lækager.
- Platin er et dyrt materiale; små mængder (f.eks. platinspulver eller -spons) blev brugt for at reducere omkostningerne, men kan med tiden blive forurenet og miste effektivitet.
Historisk betydning og bevarelse
Döbereiners lampe står som et tidligt eksempel på anvendt katalyse og viser, hvordan kemisk viden blev omsat til en dagligdags genstand. Den blev både solgt som praktisk tændingsanordning og brugt til demonstrationer i undervisning og salonsamtaler i det 19. århundrede. Kommerciel produktion ophørte omkring slutningen af 1800-tallet i takt med fremkomsten af billigere og mere praktiske tændmidler, som f.eks. tændstikker og senere moderne lightere.
Originale eksemplarer er i dag museumsgjenstande, fordi de både har teknologisk og kulturhistorisk værdi. Bevaring kræver ofte neutralisering eller fjernelse af resterende syre og korrekt opbevaring for at forhindre korrosion.
Opsummering: Döbereiners lampe fremstiller brint ved reaktion mellem zink og svovlsyre. Brinten føres forbi en platin-katalysator, som får brinten til at reagere med atmosfærisk ilt og derved antænde en flamme. Opfindelsen markerer et vigtigt skridt i anvendelsen af katalyse og var en tidlig praktisk lighter i 1800-tallet.

Döbereiner-lampe.
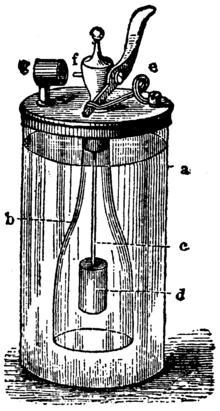
Döbereiner's lampe: a. glascylinderb . åben flaskec . kablet . zince . stopklodsf . mundstykkef. platinsvamp
Spørgsmål og svar
Sp: Hvad er Döbereiner's lampe?
A: Döbereiners lampe er en af de første lightere, der blev udviklet i 1823 af den tyske kemiker Johann Wolfgang Döbereiner. Den blev produceret indtil omkring 1880 og kan stadig ses på slottet i Heidelberg og Deutsches Museum (tysk museum).
Spørgsmål: Hvordan virker den?
A: Lighteren fungerer på grundlag af en kemisk reaktion mellem brint og ilt. I glascylinderen opbevares svovlsyre, mens zink opbevares i en åben flaske i toppen med en ventil. Når håndtaget åbnes, strømmer svovlsyre ind i flasken, som producerer brintgas, der går forbi platin, inden den reagerer med luftens ilt og danner vand som en exoterm reaktion. For at stoppe denne reaktion skal håndtaget udløses, så brint ikke længere kan løbe ud af flasken og skubber svovlsyre tilbage i sin oprindelige beholder.
Spørgsmål: Hvem opfandt Döbereiner-lampe?
Svar: Döbereiners lampe blev opfundet af den tyske kemiker Johann Wolfgang Döbereiner i 1823.
Spørgsmål: Hvor kan man finde originale versioner af denne lighter?
A: Originale versioner af denne lighter kan findes på Heidelberg Slot og Deutsches Museum (tysk museum).
Sp: Hvilke grundstoffer anvendes til denne kemiske reaktion?
Svar: Denne kemiske reaktion anvender hydrogen, oxygen, zink, svovlsyre, platin og vand som grundstoffer.
Spørgsmål: Hvad sker der, når du slipper håndtaget?
Svar: Når du slipper håndtaget, stopper du alle yderligere reaktioner, fordi brint ikke længere kan komme ud af flasken, som så skubber svovlsyre tilbage i sin oprindelige beholder.
Søge

